1.発表のポイント:
◆可視光照射下で二種類の触媒を組み合わせることにより、光反応で生じたアルキルラジカルをプロパルギル位でエナンチオ選択的に補足することで、プロパルギル位に単純なアルキル基をエナンチオ選択的に導入することに世界で初めて成功した。
◆プロパルギル位置換化合物は有用な薬理活性が知られており、本反応はプロパルギル位に単純なアルキル基を導入する新しい不斉炭素―炭素結合形成の方法を確立したものである。
◆本反応系は、可視光照射下、常温で反応が進行しており、従来の反応系に比べて反応条件はよりマイルドであり、さらに化学量論量の有機金属アルキル化剤やハロゲン試薬などを必要とせず、従来の反応系に比べてより環境に優しいクリーンな反応である。
2.発表概要:
プロパルギル位(注1)に不斉炭素(注2)を有するプロパルギル位置換化合物(注1)は、医薬品として極めて重要な化合物群である(図1)。プロパルギル位に直接置換基をエナンチオ選択的(注3)に導入する触媒的不斉プロパルギル位置換反応に関しては、2000年以降、東京大学大学院工学系研究科の西林仁昭教授らの研究グループなどにより、積極的に開発が進められてきた。しかしながら単純なアルキル基を導入する触媒的不斉プロパルギル位アルキル化反応については、アルキル化求核剤(注4)の反応性が高すぎるため、これまで報告例がなかった。
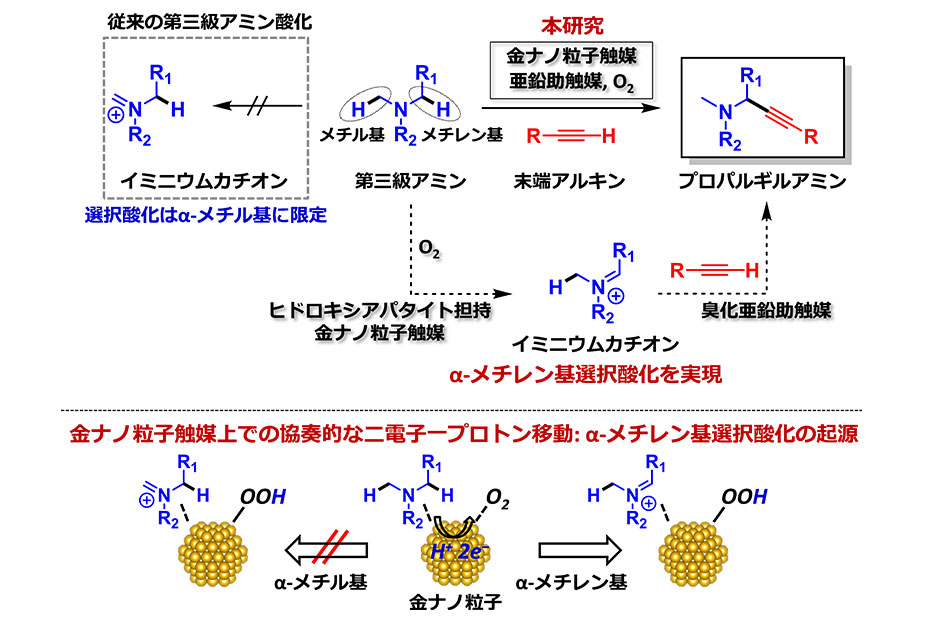
今回、東京大学大学院工学系研究科の田邉資明特任講師、西林仁昭教授らと東邦大学薬学部の坂田健教授らの研究グループは、イリジウム触媒の存在下、可視光照射による光反応でアルキルラジカル(注5)を生成する4-アルキル-1,4-ジヒドロピリジン(4-アルキル置換ハンチュエステル)(注6)に着目し、これを求核的なラジカル反応剤として用いることで、プロパルギルアルコールのエナンチオ選択的な触媒的プロパルギル位アルキル化反応に世界で初めて成功した(図2)。本触媒反応は、イリジウム触媒による光レドックス反応(注7)と、ルテニウム触媒による不斉プロパルギル位置換反応という、二種類の触媒反応系を組み合わせることで実現した(図3)。すなわち光反応によって4-アルキル-1,4-ジヒドロピリジンから生じたアルキルラジカルを、プロパルギル位置換反応における重要な反応中間体であるアレニリデン錯体(注8)が適切に補足することにより、目的の生成物が得られており(図4)、ルテニウム触媒がラジカル反応や単一電子移動(注9)で生成する反応中間体を安定化する鍵として働いたことを示す。
以上、光反応で生成したフリーラジカル(注10)をマイルドなアルキル化剤として利用することで、これまでイオン性の求核剤では実現できなかった、プロパルギル位への単純なアルキル基のエナンチオ選択的な導入に世界で初めて成功し、さらにプロパルギル位における全炭素不斉四級炭素(注11)の構築にも成功した。本反応系は、可視光照射下、常温で反応が進行しており、従来の反応系に比べて反応条件はよりマイルドであり、さらに従来の反応系で必要であった化学量論量の有機金属アルキル化剤(注12)やハロゲン試薬などを必要とせず、従来の反応系に比べてより環境に優しいクリーンな反応系である。
本研究成果は、2023年2月23日(イギリス時間)に「Nature Communications(ネイチャー・コミュニケーションズ)」(オンライン速報版)で公開された。
3.発表内容:
プロパルギル位に不斉炭素を有するプロパルギル位置換化合物は、不斉炭素に隣接する三重結合の高い反応性がもたらす薬理活性(注13)が知られており、抗エイズ剤や抗癌剤、抗生物質、避妊・中絶剤など、医薬品としても極めて重要な化合物群である(図1)。一方でプロパルギル位に直接的に置換基を導入する触媒的プロパルギル位置換反応は、位置選択性や反応中間体などの制御が困難であり、置換アレン生成物(注14)や置換アレン重合生成物(注15)などが混合物として得られてしまう(図5)。そのため触媒的プロパルギル位置換反応は開発が遅れてきた。これに対し、東京大学大学院工学系研究科の西林仁昭教授らの研究グループは、2000年の最初の報告を契機として、ルテニウム触媒などを用いた触媒的プロパルギル位置換反応の開発に成功してきた。特にエナンチオ選択的な触媒的プロパルギル位置換反応に世界で初めて成功しており、これまでさまざまな炭素原子求核剤、ヘテロ原子求核剤(注16)、ヒドリド求核剤(注17)などによる不斉プロパルギル位置換反応を実現してきた。しかしながら官能基で活性化されていない単純なアルキル基の導入に関しては、アルキル化求核剤の反応性が高すぎるなどの理由により、これまで触媒的な不斉プロパルギル位アルキル化反応は、ケトンやアルデヒド、エーテルなどの官能基を含むアルキル化求核剤を除き、報告例がなかった。
今回、本研究グループは、イリジウム触媒存在下、可視光照射による光反応でアルキルラジカルを生成する4-アルキル-1,4-ジヒドロピリジン(4-アルキル置換ハンチュエステル)に着目し、これを求核的なラジカル反応剤として用いることで、プロパルギルアルコールのエナンチオ選択的な触媒的プロパルギル位アルキル化反応に世界で初めて成功した(図2)。本触媒反応は、イリジウム触媒による光レドックス反応と、ルテニウム触媒による不斉プロパルギル位置換反応という、二種類の触媒反応系を組み合わせることで実現した(図3)。まず光レドックス反応の触媒サイクル(図4)では、光励起されたイリジウム触媒と4-アルキル-1,4-ジヒドロピリジンとの間の単一電子移動により、フリーラジカルであるアルキルラジカルが系内に生成する。一方、不斉プロパルギル位置換反応の触媒サイクル(図4)では、西林仁昭教授らの研究グループによって開発されてきたルテニウム触媒が、プロパルギルアルコールの配位と脱水により、触媒的プロパルギル位置換反応における重要な反応中間体であるアレニリデン錯体へと変換される。ここでアレニリデン錯体がフリーラジカルであるアルキルラジカルを補足してアルキニルラジカル錯体となり、さらにイリジウム触媒との単一電子移動によりアルキニル錯体へと変換され、プロトンの授受後に、高いエナンチオ選択性でプロパルギル位アルキル化生成物が得られると考えられる。すなわちルテニウム触媒の中心骨格が、ラジカル反応や単一電子移動で生成する反応中間体を安定化する鍵として働くことで、本触媒反応が進行すると推定され、このことはDFT計算(注18)の結果とも一致する。
以上、光反応で生成したアルキルラジカルをマイルドなアルキル化剤として利用することで、これまで実現できなかったプロパルギル位への単純なアルキル基のエナンチオ選択的な導入に世界で初めて成功し、さらにプロパルギル位における全炭素不斉四級炭素の構築にも成功した。本反応系は、可視光照射下、常温で反応が進行しており、従来のプロパルギル位置換反応やアルキル化反応と比べて反応条件はよりマイルドである。さらに従来の反応系で必要であった有機金属アルキル化剤やハロゲン試薬を必要とせず、カップリング反応などを利用したアルキル基を導入する従来の手法と比べてより環境に優しいクリーンな反応系である。
4.発表雑誌:
雑誌名:Nature Communications
論文タイトル:Interplay of diruthenium catalyst in controlling enantioselective propargylic substitution reactions with visible light-generated alkyl radicals
著者:Yulin Zhang, Yoshiaki Tanabe*, Shogo Kuriyama, Ken Sakata* and Yoshiaki Nishibayashi*
DOI番号:10.1038/s41467-023-36453-9
5.発表者:
張 煜林(研究当時:東京大学 大学院工学系研究科 システム創成学専攻 博士課程)
田邉 資明(東京大学 大学院工学系研究科 応用化学専攻 特任講師)
栗山 翔吾(東京大学 大学院工学系研究科 応用化学専攻 助教)
西林 仁昭(東京大学 大学院工学系研究科 応用化学専攻 教授)
坂田 健(東邦大学 薬学部 薬品物理化学教室 教授)
6.用語解説:
注1 プロパルギル位置換反応(propargylic substitution reaction)
プロパルギル位とは三重結合に隣接する飽和炭素を指し、プロパルギル位に置換基を導入する反応を「プロパルギル位置換反応」と呼ぶ。プロパルギル位置換反応は、反応の位置選択性や反応中間体などの制御が困難であり、しばしば置換アレン生成物(注14)や置換アレン重合生成物(注15)などが混合物として得られてしまうため(図5)、開発が遅れていた。
注2 不斉炭素(asymmetric carbon)
4つの異なる置換基が結合している炭素原子。
注3 エナンチオ選択的(enantioselectivity)
反応基質に対して新しい不斉要素を発現させ、かつ片方のエナンチオマー(鏡像異性体)を選択的に生成すること。
注4 アルキル化求核剤(nucleophile for alkylation)
電子密度が低い原子と反応し、その原子との間に新しい結合を作り出す化学種(求核剤)の内、化学種側の新しい結合の担い手となる原子がアルキル基の一部となる炭素原子であるもの。
注5 アルキルラジカル(alkyl radical)
炭素原子上に不対電子を持ち、かつその炭素原子がアルカン(炭化水素)を構成しているもの。
注6 4-アルキル-1,4-ジヒドロピリジン(4-alkyl-1,4-dihydropyridine)(4-アルキル置換ハンチュエステル(4-alkyl-substituted Hantzsch ester))HN(MeC=C(CO2Et))2CH2という構造を有するヘテロ環状不飽和化合物である1,4-ジヒドロ-2,6-ジメチル-3,5-ジカルボン酸ジエチルは、合成した化学者アルトゥール・ハンチュ(Arthur Hantzsch)にちなんで「ハンチュエステル(Hantzsch ester)」とも呼ばれる。この化合物は、生体内の重要な電子伝達体であるニコチンアミドアデニンジヌクレオチドリン酸(NAD+)の還元体(NADH)と類似の構造を有しており、ヒドリドドナーとして働くことが広く知られている。さらに4位にアルキル基を導入した、4-アルキル-1,4-ジヒドロピリジン(4-アルキル置換ハンチュエステル)は、光レドックス反応(注7)と組み合わせることで、マイルドなアルキル化剤として働くことが可能なアルキルラジカルを生成することが知られている。
注7 光レドックス反応(photoredox catalysis)
光反応によって誘起される触媒反応の内、単一電子移動(注9)を伴うものを「光レドックス反応」と呼ぶ。通常、基底状態にあった光増感剤(光レドックス触媒)が、光を吸収することで光励起種となる。続いて光励起種となった光増感剤が、近傍の電子受容体または電子供与体との間で単一電子移動(光励起電子移動)を起こすことで、電子受容体または電子供与体はラジカル中間体となり、一方で光増感剤は一電子酸化体または一電子還元体となる。続いて一電子酸化体または一電子還元体となった光増感剤が別の基質に対して逆の一電子移動を行うことで、基底状態に戻る。
注8 アレニリデン錯体(allenylidene complex)
R2C=C=C: の構造を有するアレン誘導体の二価ラジカル種を「アレニリデン」と呼び、アレニリデンが配位した錯体R2C=C=C=Mを「アレニリデン錯体」と呼ぶ。本錯体は金属側から三番目(γ位)の炭素原子が正電荷を帯びるため、求核的プロパルギル位置換反応において、位置選択性を制御するための重要な反応中間体である。
注9 単一電子移動(single electron transfer)
化学素反応の内、基質の間で一電子の移動を伴うもの。とりわけ、光励起によって引き起こされる単一電子移動を、「光励起電子移動」と呼ぶ。
注10 フリーラジカル(free radical)
一つ以上の不対電子を有する原子または分子を「ラジカル」と呼び、特にある一定の時間安定に存在することが可能なラジカルを「フリーラジカル」と呼ぶ。
注11 全炭素不斉四級炭素(quaternary stereogenic carbon center)
四つの異なる炭素置換基を有する不斉炭素原子。全炭素不斉四級炭素は広く生体天然物に見られる構造である。全炭素不斉四級炭素の構築は高い価値があるが、合成化学的に困難を伴うことが多い。創薬において新しい全炭素不斉四級炭素の合成法の確立は有機合成において重要な研究課題の一つである。
注12 有機金属アルキル化剤(organometallic alkylation reagent)
置換反応や付加反応により基質にアルキル基を導入することが可能な反応剤の内、反応活性中心に有機金属を含むもの。アルキルグリニャール試薬RMgX、アルキルリチウムRLi、アルキル亜鉛試薬R2Zn(R = アルキル)などが代表例である。
注13 薬理活性(pharmacological activity)
生体に投与された薬剤や化学物質が、生体の特定の生理的調節機能に対して作用する性質。
注14 置換アレン生成物(substituted allene product)
生成物として生じた、置換基が導入されたアレン。本研究内容では、プロパルギル位置換反応の副生成物として生じた置換アレンを指す(図5)。
注15 置換アレン重合生成物(polymerization product of substituted allene)
生成物として生じた、置換基が導入されたアレンの重合体。本研究内容では、プロパルギル位置換反応の副生成物として生じた置換アレンが、さらに重合することによって生成した重合体を指す(図5)。
注16 ヘテロ原子求核剤(heteroatom-centered nucleophile)
電子密度が低い原子と反応し、その原子との間に新しい結合を作り出す化学種(求核剤)の内、化学種側の新しい結合の担い手となる原子がヘテロ原子(炭素、水素以外の原子で、例えば窒素、酸素、硫黄、リンなど)であるもの。
注17 ヒドリド求核剤(hydride-centered nucleophile)
電子密度が低い原子と反応し、その原子との間に新しい結合を作り出す化学種(求核剤)の内、化学種側の新しい結合の担い手となる原子が水素原子であるもの。
注18 DFT計算(DFT calculations: density functional theory calculation)
密度汎関数理論(DFT: density functional theory)に基づく電子状態計算法。密度汎関数理論とは、電子系のエネルギーなどの物性を電子密度から計算する理論である。
7.添付資料:
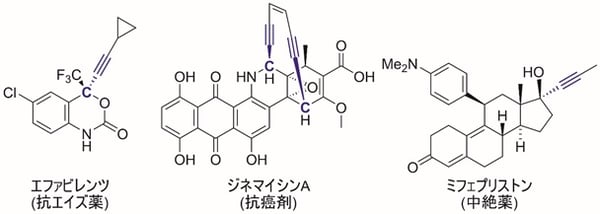
図1 プロパルギル位に不斉炭素を導入した医薬品の例
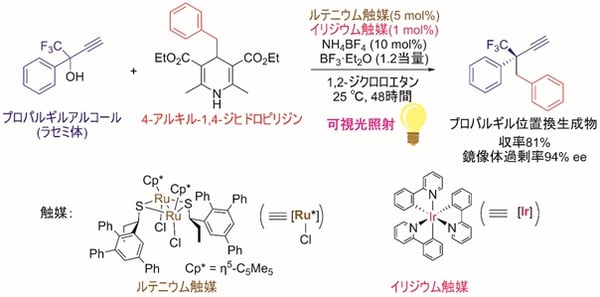
図2 可視光照射のもと、二種類の触媒を組み合わせることで実現した、プロパルギルアルコールのエナンチオ選択的な触媒的プロパルギル位アルキル化反応
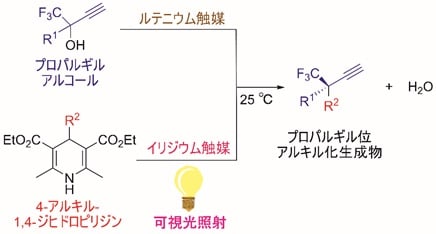
図3 二種類の触媒が関わる基質の活性化
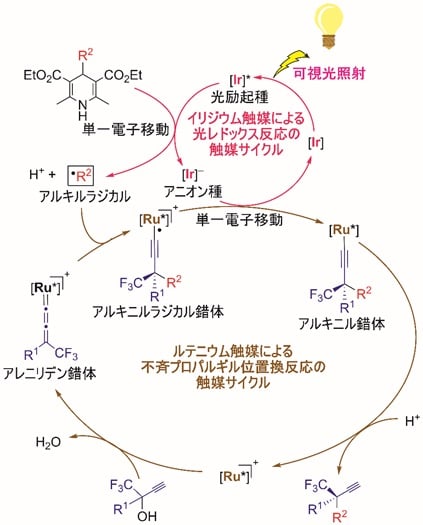
図4 イリジウム触媒による光レドックス反応の触媒サイクルと、ルテニウム触媒による不斉プロパルギル位置換反応の触媒サイクルから構成される、ラジカル反応と単一電子移動を介した推定反応機構
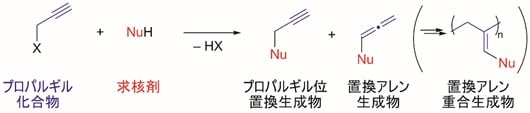
図5 従来の反応系におけるプロパルギル位置換反応の反応性制御の問題点
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-023-36453-9
おすすめ記事
本件に関連する記事はこちら