【本研究のポイント】
・脳腫瘍は手足の麻痺等の症状が出現して初めて検査されることが多く、発見された時には手術で完全に取り除くことが難しいくらい進行していることがある。脳腫瘍の生存率上昇には脳腫瘍の早期発見が必要。
・細胞外小胞(Extracellular vesicles:以下EVs)注1)には、がんや病気に関連する膜たんぱく質が含まれるため、バイオマーカー注2)として利用が期待されている。
・ウェルプレート注3)の底面にナノワイヤ注4)を作製し、EVsの捕捉とEVsの膜タンパク質の検出を同時に行うオールインワンプラットフォームを開発した。
・脳腫瘍患者と非がん患者の尿10滴から、オールインワンプラットフォームでEVsを捕捉・膜タンパク質検出を行い、膜タンパク質の発現量比(CD31/CD63)が両者で異なることを見出した。
【研究概要】
国立大学法人東海国立大学機構 名古屋大学大学院工学研究科の安井 隆雄 准教授、馬場 嘉信 教授らの研究グループは、未来社会創造機構の夏目 敦至 特任教授、東京大学大学院工学系研究科の柳田 剛 教授、長島 一樹 准教授との共同で、EVsの新しい解析プラットフォームを開発し、当プラットフォームで捕捉するEVsの膜たんぱく質の発現量が、脳腫瘍診断の新しい指標として利用可能であることを発見しました。
疾病のバイオマーカーとして注目されているEVsは、由来する細胞によって発現する膜たんぱく質の種類が異なる不均一な集団です。本研究では、ウェルプレートの底面にナノスケールの棒(ナノワイヤ)を配置し、EV捕捉とEV膜タンパク質の検出を同時に行うオールインワンプラットフォームを開発しました。このプラットフォームにより、脳腫瘍患者や非がん患者の尿サンプル中EVsの特定の2種類の膜たんぱく質の発現量比を調べたところ、発現量比が異なることが明らかとなりました。このプラットフォームを用い、他のがん患者の尿中EVsの特定の膜たんぱく質の発現量解析を進展させることで、多種のがんの早期検知が可能になると期待されます。
本研究成果は、2023年1月19日付アメリカ化学会誌「ACS Nano」のオンライン版に公開されました。
【研究背景と内容】
がんの早期発見は、近年、がん生存率上昇の一つの要因とされています。しかし、脳腫瘍の生存率はここ20年でほぼ変化がなく、これは他のがんに比べ、脳腫瘍が発見される時期が遅いことが原因の一つと考えられます。一般的に、手足が動かない、言葉が話せないといった神経症状が出現して初めてCTやMRI検査を受け、脳腫瘍が発見される患者さんが多く、その場合は腫瘍がすでにかなりの大きさに進行しているため、手術で完全に取り除くことがしばしば困難です。そのため、腫瘍が小さいうちに発見し、治療を開始することが重要と考えられます。
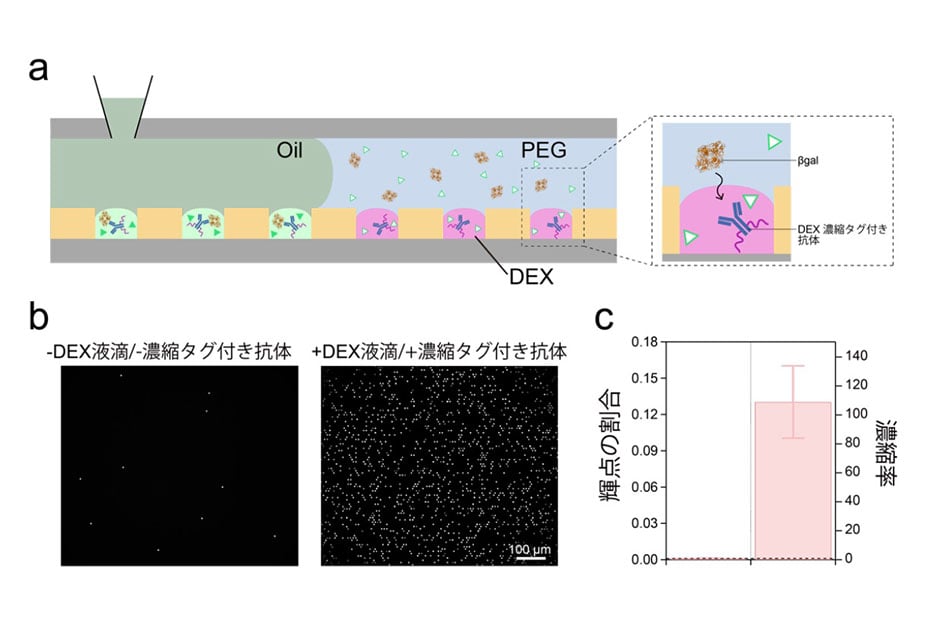
EVsには、がんや病気に関連するmicroRNA注5)や膜タンパク質注6)が含まれるため、がんや病気のバイオマーカーとしての活用が期待されています。我々は、細胞の特異的な情報となるEVsの膜タンパク質を、脳腫瘍診断のバイオマーカーの候補と考えました。多くの細胞外小胞は、血液だけでなく尿中でも壊れずに安定して存在しています。尿は誰でもいつでも簡単に、体に負担をかけることなく採取ができる利点がある一方で、超遠心法等の従来の方法では、尿から多くの細胞外小胞を集めることができませんでした。そこで、尿中の細胞外小胞が効率良く集められるナノワイヤをウェルプレートの底面に作製し、尿10滴からEVsの捕捉とEVsの膜タンパク質の検出を同時に行うオールインワンプラットフォームの開発と、尿による脳腫瘍診断方法の確立を目指しました(図1)。
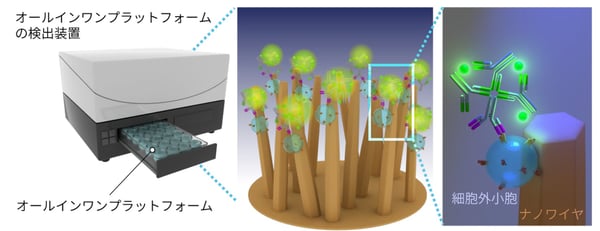
図1:オールインワンプラットフォームによる細胞外小胞の捕捉と、細胞外小胞膜タンパク質の検出の模式図。
【成果の意義】
オールインワンプラットフォームを用い、尿10滴より脳腫瘍患者さんのEVsに由来する膜タンパク質の発現量が、脳腫瘍診断の新しい指標として利用可能であることを発見しました(図2)。まず、脳腫瘍に由来するEVsが特定の膜タンパク質を有するかどうかを調べるため、脳腫瘍患者さんの腫瘍組織(オルガノイド注7))を培養し、培養液よりEVsをオールインワンプラットフォームで解析しました。膜タンパク質の発現量比(CD31/CD63)の解析を行ったところ、オルガノイドが形成される細胞と、オルガノイドが形成されない細胞では、発現量比(CD31/CD63)に差があることが分かりました。次に、脳腫瘍患者さんと非がん患者さんの尿サンプルからオールインワンプラットフォームでEVsを捕捉・膜タンパク質検出を行ったところ、膜タンパク質の発現量比(CD31/CD63)が両者で異なることも分かりました。これらの結果から、脳腫瘍細胞が放出する特徴的なEVsが尿中に存在していると考えられました。本研究から尿中のEVsは今後、脳腫瘍のバイオマーカーとして実用化される可能性が示されました。このプラットフォームを用い、他のがん患者の尿中のEVsの特定膜たんぱく質の発現量比解析を進展させることで、多種のがんの早期検知が可能になると期待されます。
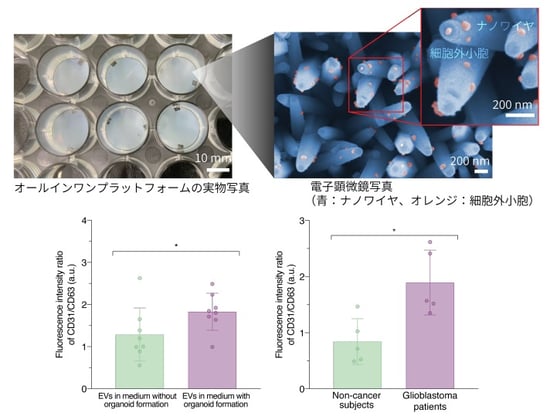
図2:(上左)オールインワンプラットフォームの実物写真(上右)ナノワイヤと捕捉されたEVsの電子顕微鏡写真(下左)。オルガノイドが形成される細胞と、オルガノイドが形成されない細胞のEVsの発現量比(CD31/CD63)(下右)。非がん患者さんと脳腫瘍患者さんの尿中のEVsの発現量比(CD31/CD63)*p < 0.05。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 個人型研究(さきがけ)「生体における微粒子の機能と制御」研究領域(研究総括:中野明彦)における研究課題「細胞外小胞の網羅的捕捉と機械的解析によるmiRNA分泌経路の解明(JPMJPR19H9)」(研究者:安井隆雄)、日本学術振興会 科学研究費補助金 基板研究B「ナノワイヤに基づく細胞外小胞の層別化法の創出と疾病診断への展開(21H01960)」(代表者:安井隆雄)、基盤研究S「堅牢な分子識別センサエレクトロニクスの学術基盤創成(18H05243)」(代表者:柳田 剛)の一環として行われました。
【用語説明】
注1)細胞外小胞(Extracellular vesicles:EVs):
細胞が分泌する直径40~2000nmの小胞体。
注2)バイオマーカー:
ある疾患の有無や、進行状態を示す目安となる生理学的指標。
注3)ウェルプレート:
多数のくぼみ(穴またはウェル)のついた平板からなる実験・検査器具で、各ウェルを試験管あるいはシャーレとして利用するものをいう。
注4)ナノワイヤ:
数10~100nmの大きさから構成される一次元の棒状のナノ構造体。
注5)microRNA:
生体機能を制御する小さなRNA。細胞内には多種類のマイクロRNAが存在し、様々な生体機能を調節している。
注6)膜タンパク質:
細胞または細胞外小胞などの生体膜に付着しているタンパク質分子。
注7)オルガノイド:
臓器の機能を有している初代組織に由来する、in vitroの3D細胞集合体。
【論文情報】
雑誌名:ACS Nano
論文タイトル:All-in-one nanowire assay system for capture and analysis of extracellular vesicles from an ex vivo brain tumor model
著者:Kunanon Chattrairat1*, Takao Yasui1-3*, Shunsuke Suzuki1, Atsushi Natsume3, Kazuki Nagashima2,5, Mikiko Iida1, Zhang Min1, Taisuke Shimada1, Akira Kato3, Kosuke Aoki3, Fumiharu Ohka4, Shintaro Yamazaki4, Takeshi Yanagida5, and Yoshinobu Baba1,3,6*
1Department of Biomolecular Engineering, Graduate School of Engineering, Nagoya University, Furo-cho, Chikusa-ku, Nagoya 464-8603, Japan.
2Japan Science and Technology Agency (JST), PRESTO, 4-1-8 Honcho, Kawaguchi, Saitama 332-0012, Japan.
3Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University, Furo-cho, Chikusa-ku, Nagoya 464-8603, Japan.
4Department of Neurosurgery, School of Medicine, Nagoya University, 65 Tsurumai-cho, Showa-ku, Nagoya 466-8550, Japan.
5Department of Applied Chemistry, Graduate School of Engineering, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8656, Japan.
6Institute of Quantum Life Science, National Institutes for Quantum and Radiological Science and Technology, Anagawa 4-9-1, Inage-ku, Chiba 263-8555, Japan.
DOI: 10.1021/acsnano.2c08526
プレスリリース本文:PDFファイル
おすすめ記事
本件に関連する記事はこちら
ヒストンH3タンパク質のクロトニル化修飾により 大腸がん細胞が増幅する仕組みを解明 〜⽴体構造解析に基づく大腸がんの新治療薬開発に期待〜
細菌の生存競争に関わるタンパク質の活性化の分子機構を解明 〜翻訳因子のこれまで知られていなかった新たな機能の発見〜