横浜市立大学大学院生命医科学研究科 構造エピゲノム科学研究室 小沼剛助教、鈴木のあさん(博士前期課程1年)、明石知子教授、東京大学大学院工学系研究科 長門石曉准教授、津本浩平教授、理化学研究所 生命機能科学研究センター 梅原崇史上級研究員、菊地正樹研究員(研究当時)、若森昌聡技師(研究当時)、中国 吉林大学 Nan Liu講師、Qiang Zhang教授、米国 マウントサイナイ医科大学 Ming-Ming Zhou教授らを中心とした研究グループは、クロトニル化*1修飾されたヒストンタンパク質*2をGAS41が認識することで転写が抑制され、がん細胞が増殖する仕組みを解明しました。この研究成果により、大腸がんに対する新しい治療薬の基盤的研究開発への展開が期待できます。
本研究成果は、「Molecular Cell」に掲載されました。(2023年6月12日オンライン)
研究成果のポイント
- ヒストンH3タンパク質のK27がクロトニル化されたクロマチン*3は転写が抑制された状態であることを発見
- クロトニル化修飾されたヒストンH3ペプチドとGAS41の複合体構造を原子分解能で解明
- GAS41、MYC、SIN3A、HDAC1が複合体を形成し、協働的に機能することでp21の転写を抑制していることを発見
- 今後、大腸がんに対する新しい治療薬の基盤的研究開発への展開が期待される
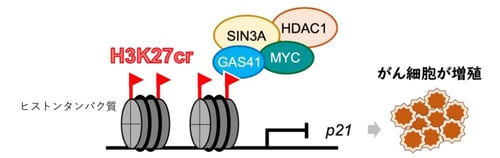
図1. ヒストンのクロトニル化修飾を起因とした大腸がん増殖機構のモデル図。ヒストンH3の27番目のリジンがクロトニル化修飾(H3K27cr)され、GAS41が結合する。GAS41はMYC、SIN3A、HDAC1と協働的に機能し、p21の転写を抑制する。この結果、細胞周期が正常に制御されず、がん細胞の分化が活性化してしまう。
研究背景
翻訳後修飾とは細胞内で合成(翻訳)されたタンパク質が受ける化学的な修飾のことです。修飾されたタンパク質は、構造安定性や活性、局在などが変化します。つまり、タンパク質の機能は遺伝子にコードされているアミノ酸配列によって決まりますが、実際にその機能を発揮する場所やタイミングはさまざまな翻訳後修飾によって制御されています。
遺伝子の転写プロセスは、ヒストンタンパク質の翻訳後修飾、高次クロマチンの構造変化、そして転写因子ネットワークによる階層的な情報伝達により厳密に制御されています。この情報伝達の破綻は、がんや炎症などの重篤な疾病につながります。そのため、この分野では基礎研究から臨床研究そして創薬研究まで幅広く行われています。とくにヒストンタンパク質の翻訳後修飾は、クロマチンの状態変化を制御することから、エピジェネティクス研究の中心的な課題の一つです。アセチル化やメチル化、リン酸化などの翻訳後修飾は、その化学修飾基を読み取る(結合する)タンパク質が複合体を形成することで生物学的機能を発揮します。これは化学修飾基を読み取るリーダータンパク質の発見が、翻訳後修飾の機能解明に重要であることを意味しています。例えばアセチル化リジンであればブロモドメイン、メチル化リジンであればクロモドメインなど、古典的な翻訳後修飾基のリーダータンパク質がよく知られています。近年、質量分析装置の高度化および測定法の発展により新しい翻訳後修飾が続々と発見されており、現在知られている翻訳後修飾は十数種類にまで及びます。しかし、新しい翻訳後修飾基のリーダータンパク質はほとんど発見されておらず、生物学的機能が分かっていませんでした。そこで本研究では、アセチル基に炭素原子を二つ、二重結合を一つ追加したクロトニル基という新しい翻訳後修飾基に着目しました(図2)。そしてクロトニル化ヒストンタンパク質を標的としたリーダータンパク質GAS41を同定し、クロトニル化修飾の生物学的機能を解明しました。
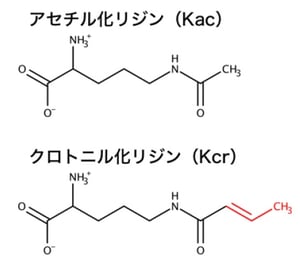
図2. アセチル化リジン(Kac)とクロトニル化リジン(Kcr)の化学構造。
研究内容
【GAS41がp21の発現を抑制する】
本研究グループは、大腸がん組織においてGAS41のmRNAが過剰に存在し、サイクリン依存性キナーゼ阻害因子であるp21のmRNAは減少している、つまりこの二つのmRNA量には負の相関があることを発見しました。そこでヒト大腸がん細胞株(HCT116)でGAS41をノックアウト*4したところ、p21の発現量が増加したことを確認しました(図3A)。さらにGAS41ノックアウト細胞にGAS41をレスキュー*5するとp21の発現量が再び下がったことから、タンパク質レベルでもこれら二つの遺伝子発現量には負の相関があることが分かりました(図3B)。
次にゼノグラフトマウスモデルを用いて、HCT116の細胞増殖におけるGAS41の必要性を評価しました。つまり免疫不全マウスの皮下にHCT116またはGAS41ノックアウトHCT116を移植し、一月後にそれらの大きさを比較しました。その結果、GAS41ノックアウトHCT116は非ノックアウトHCT116に比べて明らかに小さいことが分かりました(図4)。これらの結果から、GAS41がp21の転写を抑制し、HCT116の細胞分化が活性化していると考えられます。
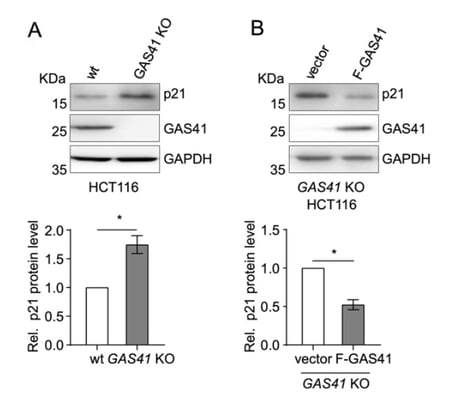
図3.A, HCT116とGAS41ノックアウトHCT116を用いたp21とGAS41のウェスタンブロティング。
B, GAS41ノックアウトHCT116にGAS41をレスキューした後のp21とGAS41のウェスタンブロティング。*P < 0.05。
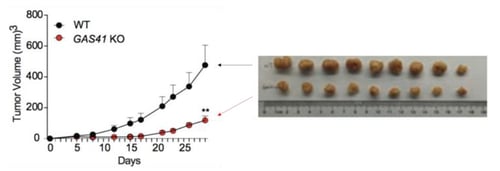 図4. HCT116(黒)とGAS41ノックアウトHCT116(赤)のゼノグラフトアッセイ。
図4. HCT116(黒)とGAS41ノックアウトHCT116(赤)のゼノグラフトアッセイ。
【GAS41はH3K27crに結合する】
核内に存在するヒストンの翻訳後修飾状態を調べるためにChip-qPCR解析を行ったところ、p21のプロモーター領域においてヒストンH3タンパク質の27番目のリジン(H3K27)がクロトニル(Cr)化されていることを発見しました。この時、クロトニル化リジン(H3K27cr)の量は、同領域に存在するアセチル化リジン(H3K27ac)よりも3倍以上多く存在し、メチル化リジン(H3K27me3)についてはほぼ検出されませんでした(図5)。
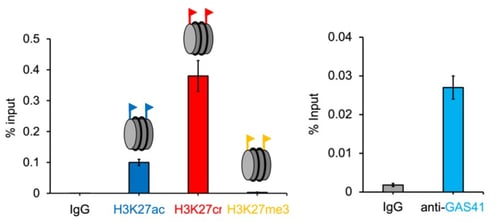
図5. p21プロモーター領域におけるH3K27ac(青)、H3K27cr(赤)、H3K27me3(黄)、GAS41(水)のChip-qPCR解析。
さらにGAS41も同領域に局在していることを発見しており、このことからGAS41がH3K27crに結合すると予想しました。
そこでGAS41とH3K27crの相互作用について定量的に評価するため、クロトニル化されたヌクレオソームコア粒子(crNCP)に対してGAS41の分子間相互作用解析(マイクロスケール熱泳動*6:MST(MicroScale Thermophoresis))を行いました。この際、アセチル化されたヌクレオソームコア粒子(acNCP)や修飾されていないヌクレオソームコア粒子(unNCP)に対しても同解析を行いました。その結果、GAS41はいずれのNCPに対しても結合すること、中でもcrNCPに対して最も強く結合することが明らかとなりました(図6)。
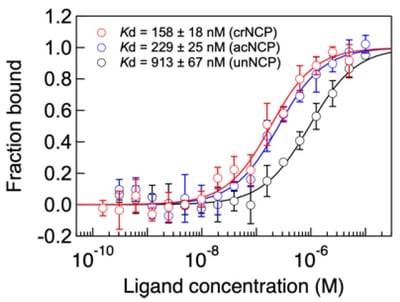
図6. crNCP(赤)、acNCP(青)、unNCP(黒)に対するGAS41のMSTアッセイ。
【H3K27cr-GAS41複合体のX線結晶構造解析*7】
GAS41のH3K27crに対する結合様式を原子分解能で理解するため、H3K27crペプチドとGAS41から成る複合体に対してX線結晶構造解析を行いました。X線回折測定は高エネルギー加速器研究機構のPhoton Factory放射光施設で実施しました。得られた立体構造からGAS41のTyr74とTrp93の側鎖がクロトニル基をサンドイッチのように挟みこむ様式(π-π-πスタッキング)により、GAS41がH3K27crに結合していることが分かりました(図7)。
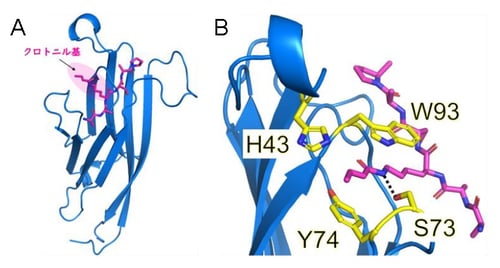 図7. A, X線結晶構造解析から得られたH3K27crペプチド(桃)とGAS41(青)の複合体構造。
図7. A, X線結晶構造解析から得られたH3K27crペプチド(桃)とGAS41(青)の複合体構造。
B, クロトニル基の認識に重要なアミノ酸残基(H43, S73, Y74, W93(黄))。
Y74とW93の側鎖がクロトニル基とπ-π-πスタッキングを形成している。
【GAS41はMYC、SIN3A、HDAC1と協働的に機能する】
p21の転写抑制機構をさらに理解するためにGAS41を用いた免疫沈降(IP (ImmunoPrecipitation))を行い、その後にウェスタンブロッティング*8をしました。その結果、がん原タンパク質として有名な転写因子MYCや転写抑制複合体として知られるSIN3AとHDAC1を検出しました(図8)。さらにHCT116のセルライセートをゲルろ過クロマトグラフィーに供したところ、同溶出画分からGAS41と共にそれらタンパク質を検出しました。また、これらのタンパク質を一種類でもノックアウトした細胞では、p21の発現抑制が緩和していることが分かりました。これらの結果を総合的に判断することで、GAS41はMYCやSIN3A、HDAC1と複合体を形成し、協働的に機能することでp21の転写を抑制していると考えられます。
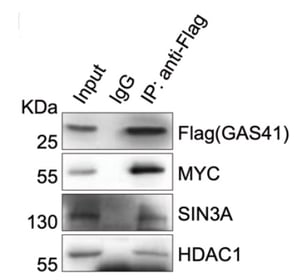
図8. GAS41を用いた免疫沈降からのウェスタンブロティング。MYCやSIN3A、HDAC1が検出された。
今後の展開
本研究では、分子生物学そして構造生物学的な観点から実験を行い、ヒストンタンパク質が受ける翻訳後修飾の一つであるクロトニル化の生物学的機能を解明しました。その成果として、クロトニル化修飾を起因とした大腸がん細胞の増殖機構を分子レベルで理解することができました。今回行った実験の中で、GAS41をノックアウトした大腸がん細胞にクロトニル化リジンに結合できない変異体GAS41をレスキューしたところ、p21の発現抑制が緩和され、その結果として大腸がん細胞の増殖が抑制されました。これはGAS41が大腸がん治療薬の分子標的であることを細胞レベルで示唆しており、GAS41とクロトニル化リジンの相互作用を阻害する化合物があれば大腸がん細胞の増殖を抑制できると考えられます。興味深いことに、上述のクロトニル化リジンが結合したGAS41複合体の立体構造解析から、クロトニル化リジンの認識部位はポケット構造を形成していることが明らかになりました。今後は、このGAS41のポケットを標的とした化合物スクリーニングを実施することで、大腸がんに対する抗がん剤開発の基盤研究への展開が期待できます。
研究費
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤 プラットフォーム(BINDS) (JP22ama121033)、公益財団法人 武田科学振興財団などの助成を受けて実施されました。
論文情報
タイトル:Histone H3 lysine 27 crotonylation mediates gene transcriptional repression in chromatin
著者:Nan Liu#,*, Tsuyoshi Konuma#, Rajal Sharma, Deyu Wang, Nan Zhao, Lingling Cao, Ying Ju, Di Liu, Shuai Wang, Almudena Bosch, Yifei Sun, Siwei Zhang, Donglei Ji, Satoru Nagatoishi, Noa Suzuki, Masaki Kikuchi, Masatoshi Wakamori, Chengcheng Zhao, Chunyan Ren, Thomas Jiachi Zhou, Yaoyao Xu, Jamel Meslamani, Shibo Fu, Takashi Umehara, Kouhei Tsumoto, Satoko Akashi, Lei Zeng, Robert G. Roeder, Martin J. Walsh, Qiang Zhang*, Ming-Ming Zhou*
掲載雑誌:Molecular Cell
DOI: https://doi.org/10.1016/j.molcel.2023.05.022
用語説明
*1 クロトニル化:
翻訳後修飾の一つ。クロトニル基は、アセチル基に炭素原子を二つ、二重結合を一つ追加した化学構造を有する。
*2 ヒストンタンパク質:
ヌクレオソームコア粒子を構成するタンパク質。ヒストンH2A、ヒストンH2B、ヒストンH3、ヒストン4が2分子ずつ集まり、八量体を形成する。例えば、ヒストンH3のN末端テールにあるリジンは翻訳後修飾を受けやすく、転写をはじめさまざまな生命現象に関わっていることが知られている。
*3 クロマチン:
真核生物の細胞核内では、DNAはヒストンタンパク質に巻き付いてヌクレソーム構造を形成する。ヌクレオソームがさらに集まった構造体をクロマチンと呼ぶ。
*4 ノックアウト:
ある遺伝子を欠損させること。細胞やマウスで遺伝子ノックアウトしたものを、ノックアウト細胞、ノックアウトマウスと呼ぶ。
*5 レスキュー:
遺伝子ノックアウトした細胞やマウスで、その欠損遺伝子を回復させること。
*6 マイクロスケール熱泳動:
異なる濃度のサンプルを含むキャピラリーを複数準備し、それぞれにレーザーを照射し、熱運動の違いを蛍光値から解析する手法。分子間相互作用の有無により熱運動性が変化し、異なる蛍光変化が得られる。
*7 X線結晶構造解析:
結晶化した物質にX線を照射して回折パターンを解析することで立体構造情報を取得する手法。
*8 ウェスタンブロッティング:
複数種類のタンパク質を電気泳動した後、抗体を用いて特定のタンパク質のみを検出する技術。
プレスリリース本文:PDFファイル
Science Direct:https://www.sciencedirect.com/science/article/pii/S1097276523003787?via%3Dihub
おすすめ記事
本件に関連する記事はこちら
免疫抵抗性の難治がんに対して、IL12 搭載ナノマシンの安全性と有効性を確認 ~Advanced Science に掲載~
関所の守りを堅めて、がん転移を阻止 ~センチネルリンパ節に核酸医薬を届けるナノマシンの開発 ~