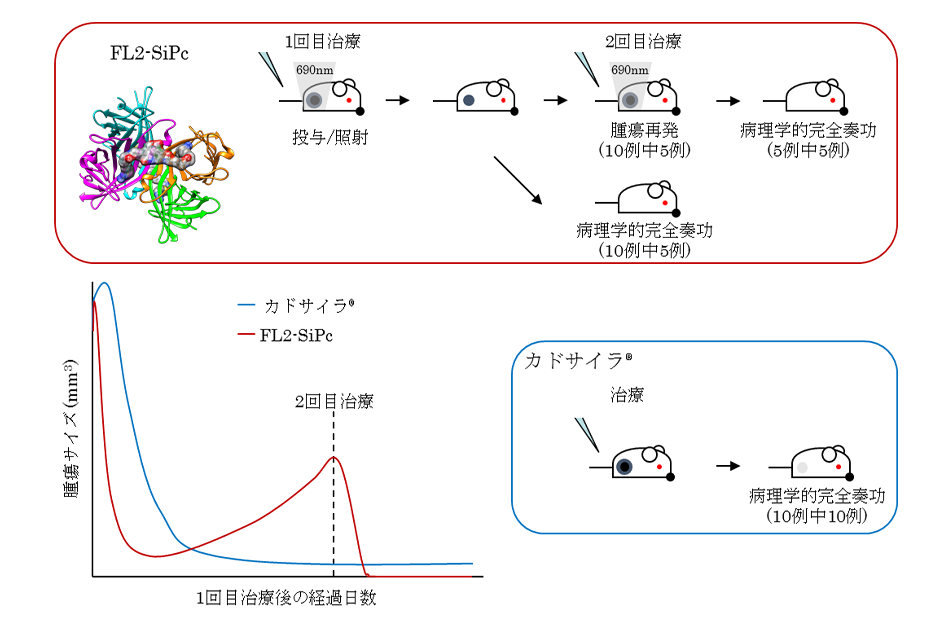
●腫瘍微小環境 (TME) において血液の灌流を妨げ、免疫細胞や薬剤による攻撃から防御する機能を持つ難治性がんとしてトリプルネガティブ乳がんのモデルマウスを用い、その画期的攻略法を実証した。
●難治性がんは、間質とよばれる線維組織を多く持ち、それがゆえに血液の灌流が悪く、腫瘍微小環境の低酸素状態をつくる。その結果、免疫抑制が起こり腫瘍組織の成長が促進される。
●間質を形成する「がん関連線維芽細胞 (CAF)」の増殖を抑制する薬剤として抗アレルギー剤「トラニラスト」が知られているが、有効性が示され中毒量とならない治療量の幅が狭く、がん治療を目的としては使い難い。
●トラニラスト搭載ナノミセルを合成し、トリプルネガティブ乳がんのモデルマウスに投与した結果、ミセル化しない場合とくらべて 1/100量でCAFの増殖抑制を有意に示した。
トラニラスト搭載ミセルとナノ製剤(エピルビシンミセルまたはドキシル)および免疫チェックポイント阻害剤の組み合わせは、腫瘍への免疫T細胞浸潤性を増加させ、免疫療法耐性乳がんを持つマウスの完全奏効と免疫記憶をもたらした。
●完全奏効したマウスに、新たな腫瘍移植を行っても腫瘍は成長できずに消失した。このことから、本法により免疫が記憶されることがわかった。
●本発表は、東京大学大学院工学系研究科のオラシオ・カブラル准教授(iCONM客員研究員)のグループとキプロス大学のトリアンタフィロス・スチリアノポウロス准教授のグループが、がん研究会東病院およびiCONMとともに共同で進める難治性がんの攻略プロジェクト。論文の詳細は以下のサイトを参照。
Panagi, F. Mpekris, P. Chen, C. Voutouri, Y. Nakagawa, J. D. Martin, T. Hiroi, H. Hashimoto, P. Demetriou, C. Pierides, R. Samuel, A. Stylianou, C. Michael, S. Fukushima, P. Georgiou, P. Papageorgis, P. C. Papaphilippou, L. Koumas, P. Costeas, G. Ishii, M. Kojima, K. Kataoka, H. Cabral* and T. Stylianopoulos*, Nature Communications 13, 7165 (2022).
DOI: https://doi.org/10.1038/s41467-022-34744-1
公益財団法人川崎市産業振興財団 ナノ医療イノベーションセンター(センター長:片岡一則、所在地:川崎市川崎区、略称:iCONM)は、同センターのオラシオ・カブラル客員研究員(東京大学大学院工学系研究科バイオエンジニアリング専攻 准教授)のグループが、キプロス大学のトリアンタフィロス・スチリアノポウロス准教授のグループと協働し、がん研究会東病院およびiCONMとともにトリプルネガティブ乳がんの新しい治療法を提唱、それが 「高分子ミセルが腫瘍微小環境を効果的にリプログラミングし、乳がんモデルマウスにおけるナノ免疫療法を増強することに成功」 と題する論文(注1)として 11/22付 Nature Communications に掲載されましたことをご報告申し上げます。
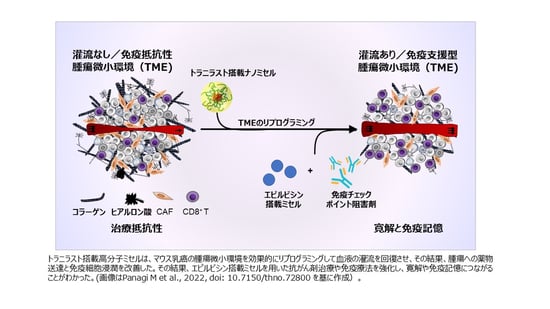
トリプルネガティブ乳がんや膵臓がんといった難治性がんは、間質と呼ばれる線維組織が発達し、まるでエネルギーシールドで覆われたエイリアンの宇宙船のごとく免疫細胞や抗がん剤といった外部からの攻撃に対して抵抗性を示します。本研究の目的は、がん化により活性化したCAF(がん関連線維芽細胞)をリモデリング(注2)し、がんのシールドとして機能している間質を弱体化させ、免疫療法や化学療法を奏効させることにあります。CAFのリモデリングに関する薬剤の研究は幅広く行われていますが、治療量(有効性を示し、中毒に至らない投与量)の幅が小さく、安全性が懸念されます。本研究では、古くからある抗アレルギー薬「トラニラスト」に着目し、それを高分子ナノミセルに搭載して腫瘍内部まで送達させた時にどの程度間質を弱体化できるかを検討しました。その結果、ミセル化せずにトラニラストを使用した場合(遊離型)と比べ、1/100量でトリプルネガティブ乳がんマウスのCAFリモデリング効果が確認できました。このことは、ナノミセル化により腫瘍およびCAFへの取り込みが、遊離型に比べて促進されたことを表しています。また、トラニラスト搭載ミセルとナノ製剤(エピルビシンミセルまたはドキシル)および免疫チェックポイント阻害剤の組み合わせは、腫瘍への免疫T細胞浸潤性を増加させ、免疫療法耐性乳がんを持つマウスの完全奏効と免疫記憶をもたらしました。さらに、トラニラスト搭載ミセルの腫瘍微小環境への作用を超音波せん断波エラストログラフィ (SWE)(注3)で非侵襲的に追跡することで、投与計画を最適化できることがわかりました。治療開始前のSWEの測定値から治療効果を予測できることを発見したことは重要で、このイメージングモダリティが奏効性予測バイオマーカーとして使用できる可能性を強く示唆するものです。
【本研究の新規性について】
低灌流は、多くの固形癌における微小環境の特徴です。低酸素、低pH、薬物の不十分な送達を引き起こし、ナノ医療や免疫療法などのがん治療効果を損なうことになります。血液供給の障害とその結果生じる低酸素状態の腫瘍微小環境は、がん細胞が免疫系を回避して浸潤・転移の可能性を高めるのにも役立っていると考えられます。
以下の点において、これまでにない知見を本研究から得ることができました。
- TME調節薬のカプセル化により、薬物動態学的特性が改善され、投与量の大幅な削減が可能になること。
- TMEを効果的に調節することで、ナノ免疫療法耐性の乳がん腫瘍モデルにおいて、完全奏効に導くことができたこと。さらには、免疫記憶を誘導することもできること。つまり、免疫系ががん細胞株に対する記憶を獲得したため、治療後の動物では腫瘍を新たに移植しても、それが再び増殖することはなかった。
- 超音波せん断波エラストログラフィ (SWE) はTME調整剤の使用を最適化し、ナノ免疫療法に対する腫瘍の奏効性を予測できること。その結果、最適な治療プロトコルを設計できること。SWEは、腫瘍の硬さを定量化するために臨床的に適用される非侵襲的なイメージング様式である。我々の研究は、免疫療法の効果を予測し、治療前に腫瘍を反応者と非反応者に分けるためのバイオマーカーとして、SWEから得られる腫瘍硬化の測定値を使用することができること。
【本研究の将来性について】
本研究は、がん細胞を直接殺すのではなく、腫瘍の微小環境を効果的にリプログラミングし、既存の治療薬が腫瘍に到達しやすい状態をつくり、その結果、治療効果を劇的に向上させることを目的とした新しいナノ粒子製剤を提案している点で意義があります。この新しいナノ粒子製剤の可能性は、本研究にて薬剤耐性乳がんモデルで示されましたが、膵臓がん、肉腫、大腸がんなど、血管の機能不全が多く見られる他の低灌流腫瘍でも有効であると期待されます。これらの腫瘍の血液供給の回復が、開発されたトラニラスト搭載ナノミセルで成され、適切なナノ療法と免疫療法のカクテルの投与とともに、原発腫瘍サイズの劇的な縮小を誘発し、効果的に肺転移を減少させることができることで全生存期間が大幅に改善し、完全治癒する可能性さえあります。 また、腫瘍灌流の程度の重要な決定指標として「腫瘍の硬さ」が定められたことにより、免疫療法予測のためのバイオマーカーとして、硬さの測定値を使用する可能性があると強調されました。現在までのところ、免疫チェックポイント阻害剤の普遍的な予測バイオマーカーは存在しません。PD-L1の発現に基づくバイオマーカーは、特定の腫瘍型にのみ提案されています。しかし、PD-L1の発現量が低くても反応する腫瘍もあれば、発現量が高くても反応しない腫瘍もあるのは事実です。腫瘍の種類によって免疫学的背景が大きく異なる可能性があり、分子情報に基づく共通の予測マーカーを同定することは非常に困難となります。一方、「腫瘍の硬さ」は、患者において非侵襲的かつ臨床的に利用可能な方法で測定することができ、前向き試験でバイオマーカーとして検証できると思います。実際、ドイツ腫瘍センター(リマソール/キプロス)およびキプロス腫瘍センター(ニコシア/キプロス)と共同で進めている臨床研究は、前臨床試験で得られた知識を臨床現場に移すことを目的としています。
注1:“Polymeric micelles effectively reprogram the tumor microenvironment to potentiate nano-immunotherapy in mouse breast cancer models”
M. Panagi, F. Mpekris, P. Chen, C. Voutouri, Y. Nakagawa, J. D. Martin, T. Hiroi, H. Hashimoto, P. Demetriou, C. Pierides, R. Samuel, A. Stylianou, C. Michael, S. Fukushima, P. Georgiou, P. Papageorgis, P. C. Papaphilippou, L. Koumas, P. Costeas, G. Ishii, M. Kojima, K. Kataoka, H. Cabral* and T. Stylianopoulos*, Nature Communications 13, 7165 (2022).
DOI: https://doi.org/10.1038/s41467-022-34744-1
注2:リプログラミング:細胞核にある遺伝情報は生涯不変であるが、各細胞は必要に応じて発現させる遺伝子を取捨選択し調節している。そのような後天的な遺伝子のモディフィケーションを消去し再構成させることを「リプログラミング」という。
注3:超音波せん断波エラストログラフィ (SWE):超音波診断装置に装着し組織の硬さを数値化する装置で、肝硬変における組織の線維化の状態や乳がんにおける腫瘍の悪性度評価に使用されている。
公益財団法人川崎市産業振興財団について
産業の空洞化と需要構造の変化に対処する目的で、川崎市の100%出捐により昭和63年に設立されました。市場開拓、研究開発型企業への脱皮、それを支える技術力の養成、人材の育成、市場ニーズの把握等をより高次に実現するため、川崎市産業振興会館の機能を活用し、地域産業情報の交流促進、研究開発機構の創設による技術の高度化と企業交流、研修会等による創造性豊かな人材の育成、展示事業による販路拡大等の事業を推進し、地域経済の活性化に寄与しています。
https://www.kawasaki-net.ne.jp/
ナノ医療イノベーションセンターについて
ナノ医療イノベーションセンター(iCONM)は、キングスカイフロントにおけるライフサイエンス分野の拠点形成の核となる先導的な施設として、川崎市の依頼により、公益財団法人川崎市産業振興財団が、事業者兼提案者として国の施策を活用し、平成27年4月より運営を開始しました。有機合成・微細加工から前臨床試験までの研究開発を一気通貫で行うことが可能な最先端の設備と実験機器を備え、産学官・医工連携によるオープンイノベーションを推進することを目的に設計された、世界でも類を見ない非常にユニークな研究施設です。
https://iconm.kawasaki-net.ne.jp/
東京大学大学院工学系研究科バイオエンジニアリング専攻について
バイオエンジニアリング専攻は、少子高齢化が進み、持続的発展を希求する社会において、人類の健康と福祉の増進に貢献することを目指します。本専攻では、この目的を達成するために、既存の工学及び生命科学ディシプリンの境界領域にあって両者を有機的につなぐ融合学問分野であるバイオエンジニアリングの教育・研究を推進します。バイオエンジニアリングの特徴は、物質・システムと生体との相互作用を理解・解明して学理を打ち立てるとともに、その理論に基づいて相互作用を制御する基盤技術を構築することにあります。生体との相互作用を自在に制御することで、物質やシステムは人間にとって飛躍的に有益で優しいものに変身し、革新的な医用技術が生まれることが期待されます。このようなバイオエンジニアリングの教育・研究を通じて、バイオメディカル産業を先導し支える人材を輩出するとともに、予防・診断・治療が一体化した未来型医療システムの創成に貢献することを目指します。
http://www.bioeng.t.u-tokyo.ac.jp/
カブラル オラシオ | 東京大学大学院工学系研究科バイオエンジニアリング専攻 (u-tokyo.ac.jp)
キプロス大学について
キプロス大学 (University of Cyprus) は1989年に創立した国立大学法人で、様々な学部、大学院、職業プログラムを有します。社会的インパクトを重視するあらゆる分野に渡り、強力な研究活動(基礎および応用)を展開しており、職員数(2022年9月時点)は、学術職員343名、特別教員57名、博士研究員、研究補助員、学術研究員、特別研究員734名、管理部門職員476名です。財政的には、国からの資金(59%)と自律的な収入(41%)によって支えられています。世界的な大学ランキングで上位にランクインするなど継続的な上昇基調にあり、欧州の未来を支える若手大学連合YUFE(Young Universities for the Future of Europe)のパートナーです。
Official Website - University of Cyprus (ucy.ac.cy)
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-022-34744-1
おすすめ記事
本件に関連する記事はこちら
サイトカイン複合体を搭載した「ナノスーパーアゴニスト」が抗腫瘍免疫を活性化
悪性脳腫瘍の中で特異的に活性化し、副作用なく治療を行う免疫チェックポイント阻害抗体の開発に成功