発表のポイント
◆ 新たな形式の二臓器灌流MPSデバイス(マイクロフィジオロジカルシステム、MPS)によって、生体に倣って灌流や酸素供給を行うことで、生体外で小腸と肝臓の臓器クロストークの観測に成功した。
◆ 小腸存在下での肝の薬物代謝能の亢進のメカニズムとして、肝からの胆汁酸が小腸によるリポタンパク質(アラキドン酸を含む)の放出を促進し、肝機能を刺激した可能性を示した。
◆ このように多臓器灌流型MPSは、正常時・疾患時の臓器クロストークを純粋な形で観測できるため、人体の持つ非線形的応答のメカニズムの理解や、臓器クロストークの制御自体をターゲットとした新たな治療戦略構築への貢献が期待される。
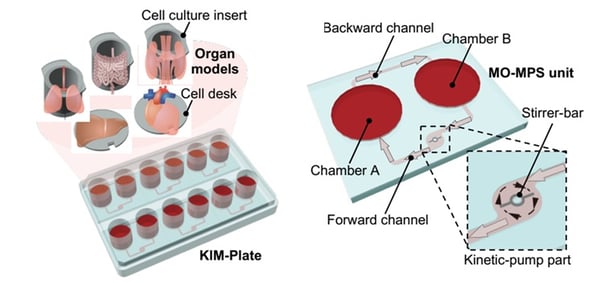
新たな形式の二臓器灌流MPSデバイス(マイクロフィジオロジカルシステム、MPS)である
“KIMプレート”
概要
東京大学大学院工学系研究科の酒井康行教授、西川昌輝准教授、D. A. Kurniawan大学院生、東海大学、東京工業大学、金沢大学、住友ベークライト株式会社、三井化学株式会社、株式会社フェニックスバイオらによる研究グループは、動物試験に代わる新たなヒト臓器細胞培養システム(マイクロフィジオロジカルシステム、MPS)(注1)を用い、肝臓機能の向上における小腸と肝臓の臓器クロストークメカニズムを明らかにした。
本研究は、新たな形式のMPSである“KIMプレート”(図1)と、ヒトiPS細胞から誘導した小腸細胞(注2)、キメラマウス由来のヒト肝細胞(注3)を用い、小腸存在下での肝の薬物代謝能の亢進を観測し、肝からの胆汁酸によって小腸によるリポタンパク質(アラキドン酸(注4)を含む)の放出が促進され肝機能を刺激するという新たなメカニズムの可能性を示した(図2)。
このように高い生理学性を実現する多臓器灌流型MPSは、ヒトの正常時・疾患時の臓器クロストークを目的とする臓器セットに絞って純粋な形で観測できるため、人体の持つ非線形的応答のメカニズムの理解や、臓器クロストークの制御自体をターゲットとした新たな治療戦略構築に貢献が期待される。
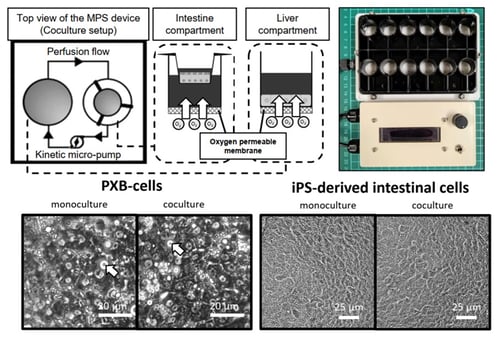
図1:新たな形式の二臓器灌流MPSデバイス(マイクロフィジオロジカルシステム、MPS)である
“KIMプレート”を使用したヒト小腸・肝の臓器クロストーク観測
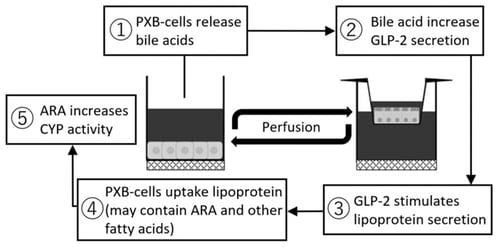
図2:二臓器MPSを用いた小腸・肝の共培養によって新たに明らかとなった臓器間クロストーク
発表内容
薬は服用後小腸で吸収され肝臓に運ばれ、肝臓で薬物はチトクロームP450(CYP)と呼ばれる酵素による代謝を受ける。また、肝臓から胆汁として腸管に排出された薬物が小腸で再吸収を受け肝臓に戻る腸肝循環と呼ばれる過程もある。このように肝臓と腸の間の臓器クロストークは、外界から摂取した医薬品・食品・化学物質等の人体への影響を大きく支配するが、そのメカニズムの解明は進んでいない。動物実験では、人体の特定の臓器間のクロストークを研究することはできないのに対して、ヒト由来の臓器細胞を搭載したマイクロフィジオロジカルシステム(MPS)と呼ばれる新たな培養システムの活用が進められているが、臓器間クロストークの観測や解明に関する報告自体が、世界的にも少ない。
今回本研究グループは、国内の優れたバイオ技術を駆使して生理学性に優れた新たなMPSを構築し、小腸・肝の臓器クロストークの解明に取り組んだ。すなわち、キメラマウスから採取したヒト肝臓細胞(PXB-cells®、株式会社フェニックスバイオ)と人工多能性幹細胞(iPSC)から培養した腸細胞を、東海大学の木村啓志教授が開発したKIMプレートと呼ばれるMPSデバイスで相互作用をさせながら培養した(図1)。本研究で用いたヒトiPS腸管細胞は東京工業大学の粂昭苑教授と白木伸明准教授のプロトコールに基づいて分化誘導されたものである。KIMプレートはマイクロスターラーの回転を活用して外付けチューブ無しの完全オンチップ灌流を実現する。これに、三井化学株式会社のInnoCell®を使用して下面から細胞へ酸素供給しつつ灌流培養し、両細胞を3日間相互作用させた。添加薬物の分析・解析は金沢大学が担当した。
肝臓のタンパク質合成能や薬物代謝能(CYP活性)の亢進には、培養液の灌流とInnoCell®を介した酸素供給に相乗効果が見られた。この条件で肝細胞について網羅的発現計測・解析(RNAシークエンシング)を行った結果、脂肪分解に関連するプロセス、特にアラキドン酸(ARA)カスケードと呼ばれるプロセスの亢進を見出した。ARAは通常は細胞膜に保持され、リポタンパク質として血中へ放出され、他の細胞に取り込まれ代謝を受け(アラキドン酸カスケード)、その代謝物が細胞内の多様な機能の調整に関与している。そこで、ARAが小腸と肝の臓器クロストークに大きく関与する可能性の検証のために、肝細胞にARAを添加する実験を行ったところ、MPS実験と同様に、肝薬物代謝能の亢進が観測された。また、胆汁排出トランスポーターであるBSEPや、腸からの脂肪放出の刺激を受けるGLP2Rの高発現も確認された。以上より、肝からの胆汁酸によって小腸からアラキドン酸を含むリポタンパク質の放出が促進され肝機能を刺激するという新たな小腸・肝の臓器クロストークメカニズムの存在の可能性を示すことができた(図2)。
以上の一連の成果は、動物を用いずにヒトでの薬物代謝研究や予測を可能とする新たな方法論の一つの重要な例である。ここでは、臓器セットを自由に変更できるので、他の臓器間クロストークメカニズムの解析にも活用でき、人体システムの非線形性の理解のための極めて有効な手法としての発展も期待できる。本研究成果は、2024年2月21日付の国際科学雑誌「PNAS Nexus」にオンライン掲載された。
〇関連情報:
「KIMプレートのデバイス開発に関する論文」(2021/8/24)
A Kinetic‐Pump Integrated Microfluidic Plate (KIM‐Plate) with high usability for cell culture-based multi-organ microphysiological systems, K. Shinha, W. Nihei, H. Nakamura, T. Goto, T. Kawanishi, N. Ishida, N. Yamazaki, Y. Imakura, S. Mima, K. Inamura, H. Arakawa, M. Nishikawa, Y. Kato, Y. Sakai, H. Kimura, Micromecanics, 12(9), 1007 (2021).
https://doi.org/10.3390/mi12091007
発表者・研究者等情報
東京大学 大学院工学系研究科
酒井 康行 教授
西川 昌輝 准教授
Dhimas Agung Kurniawan(ディマス アガング カーニアワン) 博士課程
東海大学 マイクロ・ナノ研究開発センター
木村 啓志 教授
榛葉 健汰 博士研究員
東京工業大学 生命理工学院 生命理工学系
粂 昭苑 教授
白木 伸明 准教授
Sylvia Leo(シルビア レオ) 博士課程:研究当時
金沢大学 医薬保健研究域 薬学系
加藤 将夫 教授
荒川 大 准教授
住友ベークライト株式会社 バイオ・サイエンス研究所
舩岡 創平 主幹
佐倉 武司 主幹
水野 愛子 主査
住友ベークライト株式会社 S-バイオ事業部
相原 大知 主査
井上 怜伊 主査
三井化学株式会社 新事業開発センター
松木 智昭 チームリーダー
三井化学株式会社 研究開発本部 合成化学品研究所
江刺家 勝弘 チームリーダー
株式会社フェニックスバイオ 生産部
稲松 睦 課長
論文情報
雑誌名:PNAS Nexus
題 名:Gut-Liver Microphysiological Systems Revealed Potential Crosstalk Mechanism Modulating Drug Metabolism
著者名:Dhimas Agung Kurniawan *, Sylvia Leo, Mutsumi Inamatsu, Sohei Funaoka, Taichi Aihara, Mizuno Aiko, Inoue Rei, Takeshi Sakura, Hiroshi Arakawa, Yukio Kato, Tomoaki Matsugi, Katsuhiro Esashika, Nobuaki Shiraki, Shoen Kume, Kenta Shinha, Hiroshi Kimura, Masaki Nishikawa, Yasuyuki Sakai
DOI:10.1093/pnasnexus/pgae070
URL:https://doi.org/10.1093/pnasnexus/pgae070
研究助成
本研究は、AMED再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療技術を応用した高度な創薬支援ツール技術開発)の「オンチップ灌流型MPSを基礎とした肝と他臓器が関与する薬物動態・毒性の予測系開発」(課題番号:22be1004201h0001)」の支援により実施された。
用語解説
(注1)MPS:マイクロフィジオロジカルシステム=微小な生理学的細胞培養システム。マイクロ流体デバイス技術他の各種微細化技術を用いて、従来のディッシュやプレートを用いる細胞培養ウェアでは再現が困難であった、培養液の灌流や3D構造構築・力学的刺激等を可能とする新たな細胞培養システム・ウェア。単臓器に着目したものから複数臓器の搭載を可能とするものまで世界中で激しい開発競争がされている。ヒト細胞を搭載することで種差の問題を回避できることから動物実験代替法としても高く注目されている。
(注2)ヒトiPS細胞から誘導した小腸細胞:ヒトの発生過程を模倣し、ヒトiPS細胞に様々な増殖因子カクテルを逐次添加培養することで、徐々に成熟レベルの高い機能を持った腸管細胞へと分化誘導したもの。従来用いられてきたヒト結腸癌由来の細胞株であるCaco-2細胞とは異なり、代謝酵素や能動輸送のためのトランスポータータンパク質の活性をヒト腸管レベルにまで高めることができる。
(注3)キメラマウス由来のヒト肝細胞(PXB-cells®):一種の免疫不全肝障害マウスの幼少時にヒト肝細胞を移植することで、成熟時には肝臓の70%以上がヒト肝細胞に置換される。このマウスから新鮮なヒト肝細胞を多量に得ることができ、移植不適格ドナー肝からの凍結肝細胞に代わる新たなヒト肝細胞ソースとして利用が拡大している。
プレスリリース本文:PDFファイル
PNAS Nexus:https://academic.oup.com/pnasnexus/article/3/2/pgae070/7604466
おすすめ記事
本件に関連する記事はこちら

先端システム技術研究組合(組合員:東京大学、 アドバンテスト、凸版印刷、日立製作所、 ミライズテクノロジーズ、理化学研究所)が、 チップ設計の民主化に向けた 次世代先端半導体設計プラットフォームの研究開発を開始
新規抗ウイルス材料のハイスループットスクリーニング系を共同開発


