発表のポイント
◆ 固体科学の概念を液体材料(電解液)に展開し、電極-イオン間の電子授受のしやすさ(電極電位)を記述する新たな電気化学理論を提唱。
◆ 100年来の未解決問題であった、濃厚電解液における電極電位の定量評価を、数値シミュレーションにより初めて実現。
◆ 蓄電池の正極・負極の電極電位と電解液の関係が数値的に可視化されたことで、電池材料の全体最適化による二次電池高性能化に貢献。

固体と液体を繋ぐ電気化学の新理論を提案
発表概要
東京大学大学院工学系研究科の山田淳夫 教授、竹中規雄 特任講師、コソンジェ(Ko Seongjae) 助教、北田敦 准教授らのグループは、固体科学の概念を液体である電解液(注1)に展開し、電極-イオン間の電子授受のしやすさ(電極電位、注2)を記述する電気化学理論モデル(液相マーデルングポテンシャル)を新たに提唱した(図1)。本研究では、数値シミュレーション(分子動力学法、注3)を用い、電解液中でリチウムイオンの感じる静電的な居心地の良さ(液相マーデルングポテンシャル)を直接計算することで、従来の古典的理論では扱うことのできなかった、濃厚電解液における電極電位の定量評価に初めて成功し、100年来の未解決問題を解決した。また、電解液に依存する電極電位シフトの物理的起源が、電解液中のリチウムイオンの液相マーデルングポテンシャルのシフトに起因することを明らかにした。これにより、本質的知見に基づく電池材料の全体最適化と二次電池の革新的性能発現に貢献すると期待される。
本研究成果は、2月19日付の英国の学術雑誌Nature Communications電子版に掲載された。

図1:固体と液体を繋ぐ電気化学の新理論を提案
液体中のリチウムイオンが感じる静電的な居心地の良さ(液相マーデルングポテンシャル)を理論的に計算し、100年来の未解決問題であった、濃厚電解液における電極電位の定量評価が可能となった。
発表内容
〈研究の背景〉
2050年にカーボンニュートラルを達成するには、太陽光や風力などの再生可能一次エネルギーによる発電システムの導入や電気自動車の普及が必須であり、電気エネルギーを柔軟に受給できる優れた蓄電システムの開発が不可欠である。そのためには、高度な設計コンセプトに基づいて、蓄電池材料の性能を最大限に引き出すことが求められる。
蓄電池は主に電極材料と電解液材料から構成され、電極-イオン間の電子授受のしやすさを表す指標が電極電位である。電極電位が電解液に依存してシフトすることは、物理化学・電気化学の教科書に数十ページを割いて必ず記載されている一般現象であり、これにより電極反応効率や充放電サイクル特性が影響を受けることも古くから知られている。しかし、その定量解釈に関しては、1923年に超希薄系において溶媒やイオンとの相互作用を近似的に扱ったデバイ-ヒュッケル理論(注4)が提案されて以来、実用上重要な濃厚電解液を記述する適切なモデルは存在しなかった。蓄電池材料の自在設計には、濃厚電解液の電極電位を定量的に記述できる理論モデルの構築が求められていた。
〈研究の内容〉
本研究グループは、固体科学の概念であるマーデルングポテンシャル(注5)を液体系に展開し、濃厚電解液における電極電位を定量的に記述する電気化学の新たな理論モデル(液相マーデルングポテンシャル)を提唱した。
本研究では、数値シミュレーション(分子動力学法)を用い、リチウムイオンと周辺化学種(溶媒や陰イオン)とのクーロン相互作用を計算することで、電解液中でリチウムイオンの感じる静電的な居心地の良さ(液相マーデルングポテンシャル)を求めた。電解液の濃厚化による液相マーデルングポテンシャルの変化分を電位シフトに換算すると、実験で測定した電極電位上昇分を精度良く再現できることがわかった(図2)。また、電解液に依存して電極電位がシフトする物理的起源が、電解液中のリチウムイオン周囲の配位環境の変化による静電的な不安定化に起因することを明らかにした(図3)。
これは一世紀もの長きにわたり電気化学分野で強く希求されながら達成できなかった理論的進展であり、本質的知見に基づく電池材料の全体最適化が可能となる。実際に、多くの電池系でその有効性が証明されつつある。
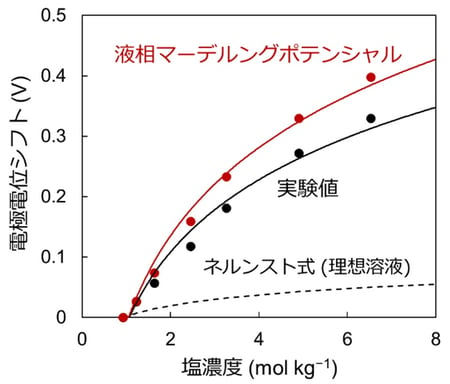
図2:液相マーデルングポテンシャルによるリチウム電極電位シフトの定量評価
リチウム電極電位シフトの実験値(黒丸)と液相マーデルングポテンシャルに基づく計算値(赤丸)、ならびに理想溶液(破線;活量係数が1の場合のネルンスト式から計算)の場合のシフト量を示す。リチウムビスフルオロスルホニルイミド/炭酸プロピレン電解液(LiFSI/PC)に関して、通常濃度(0.9 mol kg-1)からのシフト量を塩濃度の関数としてプロットしたところ、従来理論では記述できない濃厚電解液の電極電位シフトを定量的に評価することができた。
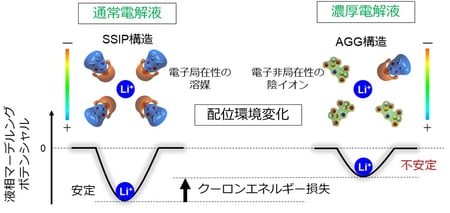
図3:電位アップシフトのメカニズムを表す模式図
濃厚電解液ではリチウムイオンの配位環境が変化し、クーロンエネルギー損失により液相マーデルングポテンシャルが不安定化する。これにより、電極電位が大きくアップシフトする。具体的には、溶媒分離イオン対(solvent-separated ion pair(SSIP))構造という電子局在性の溶媒が配位した環境から、イオン会合(aggregate(AGG))構造という電子非局在性の陰イオンが主に配位した環境に変化している。
〈今後の展望〉
工業電気化学における実用電解液は、デバイ-ヒュッケル理論が適用できない濃厚電解液である。濃厚電解液系に対する電極電位の定量記述モデルが確立できたことは、電池に限らず、めっきや製錬などを含めたさまざまな電気化学システムの設計性向上に資するものであり、その産業応用インパクトは大きい。このことは、低炭素・持続可能社会の実現に向けた広汎なエネルギー貯蔵・変換技術の性能向上に貢献すると期待される。
発表者
東京大学大学院工学系研究科化学システム工学専攻
山田 淳夫 教授
竹中 規雄 特任講師
コ ソンジェ(Ko Seongjae) 助教
北田 敦 准教授
論文情報
雑誌名:Nature Communications
題 名:Liquid Madelung energy accounts for the huge potential shift in electrochemical systems
著者名:Norio Takenaka, Seongjae Ko, Atsushi Kitada, Atsuo Yamada*
DOI:10.1038/s41467-023-44582-4
URL:https://doi.org/10.1038/s41467-023-44582-4
研究助成
本研究は主に、文部科学省データ創出・活用型マテリアル研究開発プロジェクト「再生可能エネルギー最大導入に向けた電気化学材料研究拠点」(DX-GEM、課題番号:JPMXP1122712807)、科学研究費助成事業基盤研究S(課題番号:20H05673)の支援により実施されました。
用語解説
(注1)電解液
蓄電池の正極と負極の間において特定のイオンの移動を媒介する液体材料。一般的な商用リチウムイオン電池の電解液は、溶媒分子、リチウムイオン、陰イオンから構成される液体であり、有機溶媒にリチウム塩を溶解した溶液が用いられる。
(注2)電極電位
電極活物質がイオンと反応する際の電子授受のしやすさを規定する指標値。例えば、リチウムイオン電池では負極と正極の間をリチウムイオンが行き来することで充放電が行われるが、電極電位が高いほど負極ではリチウムイオンが還元されやすくなり、逆に正極では酸化されづらくなる。リチウムイオン電池の安定作動を実現するためには、負極と正極の電極電位を電解液が分解しない電位領域(電位窓)に収めて(あるいは近づけて)、電解液の副反応を熱力学的に抑えることが重要である。
(注3)分子動力学法(MD法)
原子間に働く相互作用ポテンシャルのもとでニュートンの運動方程式を解き、原子の動的な振る舞いから材料の構造や物性を求める数値シミュレーション。本研究のような電解液中でリチウムイオンの感じる静電的な居心地の良さ(液相マーデルングポテンシャル)を直接計算することは、100年前には不可能であった。
(注4)デバイ-ヒュッケル理論
100年以上前に提唱された、電極電位(または電解液中のイオン活量)の濃度依存性を表す電気化学の古典的理論であり、非常に希薄な溶液(0.1 mol/kg以下)にしか適用できない。より高い濃度領域に適用するために各種経験的パラメータを追加した拡張デバイ-ヒュッケル理論も提案されているが、これらの経験的パラメータの物理的意味はあいまいであり、濃厚電解液における電極電位の定量解釈はこれまで達成されていなかった。
(注5)マーデルングポテンシャル
イオン結晶におけるイオン間のクーロン相互作用の総和。本研究では、イオン結晶と凝集系としての電解液との類似性に基づいて、液体中のイオンが感じる静電ポテンシャル(液相マーデルングポテンシャル)を、電極電位を記述する新たな説明因子として導入した(詳細は電気化学会誌2023年Volume91.No2,p140の解説記事を参照)。溶液中ではイオンや溶媒は自由に移動するため、分子動力学法を用いて各時刻でイオンや溶媒とのクーロン相互作用の総和を計算し、さらに時間平均をとることで液相マーデルングポテンシャルを求めた。
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-023-44582-4
おすすめ記事
本件に関連する記事はこちら
強誘電体二酸化ハフニウムジルコニウム中における不揮発屈折率変調を実証 ―プログラミング可能な光回路への応用に期待―
非磁性半導体に大きなスピン分裂を観測、 電圧で制御できることを実証 ―次世代半導体スピントロニクス・デバイス実現可能性の開拓―