発表のポイント
◆遺伝子治療の臨床応用においては、遺伝子治療に用いられるアデノ随伴ウイルスベクター(AAV)が治療対象以外の部位に作用し、意図しない合併症をもたらすリスクがあります。本研究では、AAVによる遺伝子導入の効果を局在化させ、遺伝子治療の潜在的なリスクを減らす方法を開発しました。
◆バイオマテリアルとして広く用いられているポリエチレングリコール(PEG)の分解特性を最適化することによって、マウスの皮膚潰瘍表面への遺伝子導入効率を保ちながら、深部組織、遠隔臓器における意図しない作用を減らすことに成功しました。
◆局所的な病態を対象とした遺伝子治療に伴う潜在的な合併症発生のリスクを減らすことによって、遺伝子導入を用いた生体内リプログラミング、生体内ゲノム編集など、強力な治療手段の研究開発に応用されることが期待されます。
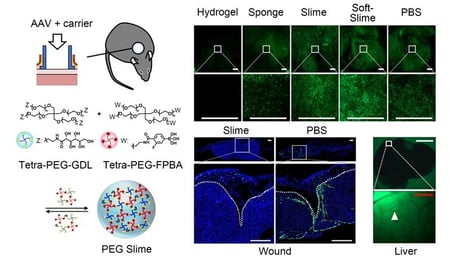
本研究の概要図:PEGスライムによって皮膚潰瘍面以外での非特異的な遺伝子発現を減らすことに成功
発表概要
東京大学大学院医学系研究科の加藤基大学院生(研究当時)、岡崎睦教授、東京大学医学部の栗田昌和講師と東京大学大学院工学系研究科の石川昇平助教、酒井崇匡教授らによる研究グループは、皮膚潰瘍表面をターゲットとしたアデノ随伴ウイルスベクター(AAV)(注1)による遺伝子導入の効果を局在化させる方法を開発しました。
本研究グループが開発した医療用ゲル(テトラPEGシステム;注2)、なかでも動的な共有結合をもつように設計されたPEGスライム(注3)をキャリアとして緑色蛍光タンパク質(GFP)(注4)を発現するAAVをマウスの皮膚潰瘍面に投与すると、キャリアを用いずに投与した場合と比較して、潰瘍表面付近の細胞におけるGFP発現頻度を低下させることなく、より深い部位や代表的な遠隔臓器である肝臓におけるGFP発現を減らすことができました。
高い自由度で溶解特性を調整することが可能なPEG高分子をドラッグデリバリーに用いることによって、局所的な病態を対象とした遺伝子治療に伴う潜在的な合併症発生のリスクを減らしうることが示唆されました。本研究グループが開発を進める生体内リプログラミングによる皮膚潰瘍治療(注5)、組織胎児化による複合的組織再生法(注6)など、強力な治療法の研究開発に応用されることが期待されます。
本研究成果は、5月16日(英国夏時間)に「Communications Biology」で公開されました。
発表内容
〈研究の背景〉
AAVは、生体内の細胞への遺伝子導入に用いられる強力なベクターで、リポ蛋白リパーゼ欠損症、脊髄性筋萎縮症、網膜ジストロフィー、血友病などに対して臨床的に用いられているほか、より最近では生体内ゲノム編集による治療法開発にも広く用いられています。
バイオ医薬品開発の重要な一角を担う一方で、投与されたAAVは治療効果を期待する臓器以外の部位で作用し、意図しない合併症を引き起こす可能性があります。これまで、AAV作用部位の特異性の制御方法として、AAVカプシドの組織・細胞指向性の最適化、組織特異的プロモーターの使用、投与経路の検討などが試みられてきました。
一方、本研究チームは高齢化社会において増加しつつある褥瘡(じょくそう)、糖尿病性潰瘍、末梢血管不全による組織壊死などに対する革新的な治療法の開発を目的として、生体内リプログラミングによる皮膚潰瘍表面からの新規皮膚誘導法の開発・組織胎児化による複合的組織再生法の開発など、主に皮膚潰瘍局所に対する治療的介入法の開発に取り組んできました。
〈研究の内容〉
本研究では、局所的な病態に対する遺伝子導入の臨床的な安全性を向上させる方法の開発を目的に、皮膚潰瘍表面に対して、AAVをベクターとする遺伝子導入実験系におけるポリエチレングリコール(PEG)を原料とする高分子キャリアの有効性を検討しました。
架橋構造・孔径の異なる3種類のPEGキャリアである、PEGハイドロゲル、PEGスポンジ、PEGスライムについて、高分子構造の溶解と、混合させたナノ粒子の放出の関係性を調べたところ、PEGハイドロゲル、PEGスポンジは溶解に先んじて放出が開始されるのに対して、動的な架橋構造をもつPEGスライムでは、溶解と並行して放出がおきていました。
マウスの背部に装着したスキンチャンバー内の皮膚潰瘍にPEGハイドロゲル、PEGスポンジ、PEGスライム、より柔らかいPEGソフトスライム、食塩水をキャリアとしてGFPを発現するAAVを投与し、潰瘍表面のGFP陽性細胞数を評価したところ、PEGスライム、PEGソフトスライムをキャリアとした場合には食塩水で投与した場合と同等の高い遺伝子導入効率が保たれていました(図1)。
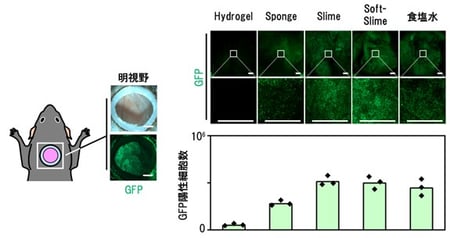
図1:皮膚潰瘍表面へのPEGキャリアを用いた遺伝子導入効率の検討
PEGスライムおよびPEGソフトスライムキャリアは高い潰瘍表面への遺伝子導入効率を保っていた。
一方、PEGスライムをキャリアとすることによって、主たるターゲットではない深部皮膚組織、およびAAVが非特異的に作用する代表的な遠隔臓器である肝臓における遺伝子導入が有意に減少していました(図2)。
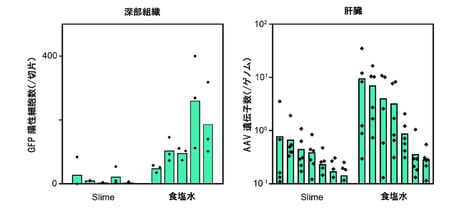
図2:深部組織および肝臓に対する遺伝子導入効率の検討
深部組織におけるGFP陽性細胞数ならびに肝臓におけるAVV遺伝子数に関して、PEGスライムキャリア群と食塩水をキャリアとした群とを比較した結果。PEGスライムキャリアによって深部皮膚組織および肝臓における遺伝子導入は共に減少していた。
PEGスライムがどのように作用して皮膚潰瘍表面以外での遺伝子導入を減少させているのかを調べるために、各キャリアを用いてGFP標識されたAAVと同程度の大きさのナノ粒子を皮膚潰瘍面に投与したところ、PEGスライムでは、投与後24時間の時点で皮膚潰瘍表面のナノ粒子数が増加していることがわかりました。一方、培養細胞を用いた実験によって常温状態のAAVは時間とともにその遺伝子導入能を失うことが明らかとなりました。
これらのことから、PEGスライムによる深部組織および遠隔臓器における遺伝子導入の減少は、皮膚潰瘍表面に対するAAV作用量の増加と、経時的なAAVの不活性化とのバランスによってもたらされていることが示唆されました。
〈今後の展望〉
本研究から、適切な分解・放出特性をもつPEG高分子をキャリアとして用いることによって、皮膚潰瘍表面に対する遺伝子導入を高度に局在化させうることがわかりました。高い自由度で溶解特性を調整することが可能なテトラPEGから構成される高分子をドラッグデリバリーに用いることによって、局所的な病態を対象とした遺伝子治療に伴う潜在的な合併症発生のリスクを減らしうることが示唆されました。
本知見は、強力な治療効果が期待される反面、ターゲットとして想定していない部位で重篤な合併症をもたらす可能性のある生体内リプログラミングや生体内ゲノム編集など、局所的遺伝子治療の研究開発、主に臨床応用に際する安全性向上に応用されることが期待されます。
〈関連のプレスリリース〉
「コロナワクチンや化粧品にも使用されるポリエチレングリコールの体内動態解明に貢献」
(2023/4/6)
https://www.t.u-tokyo.ac.jp/press/pr2023-04-06-001
発表者
東京大学
大学院医学系研究科
加藤 基(医学博士課程:研究当時、現:岡山大学病院 助教(特任))
岡崎 睦(教授)〈東京大学医学部附属病院 形成外科・美容外科〉
医学部
栗田 昌和(講師)〈東京大学医学部附属病院 形成外科・美容外科〉
大学院工学系研究科
石川 昇平(助教)
片島 拓弥(講師)
酒井 崇匡(教授)
論文情報
〈雑誌〉Communications Biology
〈題名〉In situ-formable, dynamic crosslinked poly(ethylene glycol) carrier for localized adeno associated virus infection and reduced off-target effects
〈著者〉Motoi Kato, Shohei Ishikawa, Shen Qi, Du Zening, Takuya Katashima, Mitsuru Naito, Takao Numahata, Mutsumi Okazaki, Takamasa Sakai*, and Masakazu Kurita*
〈DOI〉10.1038/s42003-023-04851-w
研究助成
本研究は、国立研究開発法人日本医療研究開発機構(AMED)ムーンショット型研究開発事業(*;21zf0127002)、科学技術振興機構(JST)戦略的創造研究推進事業 CREST(No.JPMJCR1992)、科学研究費補助金(20H03847、20K20609、21H04688、20H05733、21J10828、20J01344、20K15338) の支援を受けたものです。
(*)ムーンショット型研究開発事業
AMEDはムーンショット目標7「主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現」に向け、我が国発の破壊的イノベーションの創出を目指し、より大胆な発想に基づく挑戦的な研究開発(ムーンショット)を推進しています。特に国の運用評価指針に則って、研究開発資金の支援のみならず、アドバイザーによる多くの助言、技術交流会による連携の促進、毎年実施の自己評価による指導助言、シンポジウム開催によるアウトリーチ活動等幅広く支援を行っています。
用語解説
(注1)アデノ随伴ウイルスベクター(AAV):
遺伝子導入に用いられるウイルスベクター。生体への遺伝子導入における安全性が高く、臨床的な遺伝子治療に用いられている。
(注2)テトラPEGシステム:
東京大学大学院工学系研究科 酒井 崇匡教授によって開発された、ポリエチレングリコール(PEG)を原料とする均一な網目構造をもつ一連の高分子を作成するシステム。水に溶けやすく、毒性が低いため止血剤、人工硝子体、細胞足場などさまざまな用途での臨床応用が期待されている。
(注3)PEGスライム:
多分岐ポリエチレングリコールの末端を可逆的に結合することで、常に組み換えが起こる動的な網目構造を形成させた材料。ゲルのような弾性と、溶液的な粘性を両立し、適切な時間スケールで体内に溶出させることが可能なため、バイオマテリアルとして期待されている。
(注4)緑色蛍光タンパク質(GFP):
緑色の蛍光をもつタンパク質。遺伝子導入された細胞が蛍光にラベルされることから遺伝子導入効率の検討に用いられる。
(注5)生体内リプログラミングによる皮膚潰瘍治療:
生体内リプログラミングとは、成体内に存在する細胞のDNAに働きかけることによって、細胞の種類をかえること。本研究チームは皮膚潰瘍表面に存在する細胞から皮膚表面、毛髪などを誘導する方法を開発してきた。
(注6)組織胎児化による複合的組織再生:
本研究チームが現在取り組んでいる、成体内に存在する細胞を胎児期の細胞に生体内リプログラミングし、発生期の組織状態を再度誘導することによって複合的な組織の再生を誘導する方法。
プレスリリース本文:PDFファイル
Communications Biology:https://www.nature.com/articles/s42003-023-04851-w
おすすめ記事
本件に関連する記事はこちら

