発表のポイント
◆回転分子モーターであるATP合成酵素の「留め金」として働く回転制御因子IF1は、モーターが時計回り方向に回転するときのみ外れやすいという、回転方向に依存した解離機構を持つことを明らかにしました。
◆回転方向に依存した制御機構には「留め金」とモーターの回転子との接触が重要であることを示し、IF1のアミノ酸残基ごとの役割を明らかにしました。
◆今回の研究で解明された「IF1の回転方向依存的な制御機構」は無駄なATP分解を抑えるという生化学的な要求と合致しており、これらの知見は新規制御因子のデザイン・創成につながると期待されます。

モーターを時計回りに回転させることで「留め金」が外れる様子
発表概要
東京大学大学院工学系研究科の小林稜平特任研究員(研究当時、現所属:分子科学研究所計算科学研究センター 日本学術振興会特別研究員)、上野博史講師、野地博行教授、分子科学研究所の岡崎圭一准教授らの研究グループは、回転分子モーターであるATP合成酵素の制御因子IF1がモーターの回転方向に依存して解離するという制御機構を明らかにしました。これまでの研究では、モーターの回転を止めるための「留め金」として働くIF1が「どのように回転を止めるか」については理解が進んでいたものの、「どのようにモーターから外れるか」については不明のままでした。本研究では磁気ピンセットと呼ばれる電磁石対を用いることで、モーターに結合したIF1が効率的に解離する条件を調べました。その結果、モーターを時計回り方向に強制回転させた場合にIF1が外れる現象が観察されました。ATP加水分解時にはモーターが反時計回り方向に回転するため、IF1を解離させるにはモーターを自律的な回転方向とは逆の、ATP合成方向へ回転させる必要があることがわかりました。つまり、この性質はIF1が無駄なATP分解反応を抑制するという生化学的な観察結果に合致しており、モーターの回転方向に依存したIF1の解離機構が明らかになりました。また、IF1を構成するアミノ酸を段階的に削除した変異体を用いた実験により、回転方向依存的なIF1解離機構にはモーターの回転子とIF1の接触が重要であることが示唆されました。これらの結果は、回転分子モーターの制御機構を明らかにしただけではなく、IF1をベースとした新たな制御タンパク質の人工設計や創成につながることが期待されます。
発表内容
〈研究の背景〉
アデノシン3リン酸(ATP)はあらゆる生物の生命活動の維持に必須であり、「生物のエネルギー通貨」として知られています。生体内でその大部分を産生しているのがATP合成酵素(FoF1)というタンパク質です。FoF1は、膜に内在してプロトン(H+)を輸送するFoモーターと、膜外に存在して触媒反応を担うF1モーターと呼ばれる2つの回転分子モーターが結合した複合体です。すなわち、生体膜間に形成される膜電位(注1)に沿ってH+が移動するときにADPと無機リン酸(Pi)からATPが合成されています。この酵素は膜内外に形成されたプロトン駆動力(注2)の大小によって両方向に回転することができます。つまり、ATP合成を行うときは膜から見て時計回り方向に、ATP分解を行うときは反時計回り方向に回転します。
通常、生体内ではF1モーターは時計回り方向に回転してATP合成反応を触媒します。しかし、疾病などによりプロトン駆動力が低下すると、F1は反時計回り方向に回転してATP分解反応を触媒します。これはATPの浪費につながるため、生体内では厳密に制御されています。ATP加水分解反応を制御するシステムとして、ミトコンドリア型FoF1にはIF1(ATPase inhibitory factor 1)と呼ばれる制御因子が存在しています。IF1は、プロトン駆動力が高く維持された条件ではFoF1によるATP合成反応は阻害しないものの、プロトン駆動力が低下するとFoF1によるATP加水分解反応を阻害することが知られています(図1)。これまでの研究では、IF1がどのようにF1モーターの回転を止めるかについては理解が進んでいたものの、F1モーターからどのように外れるかについては不明のままでした。
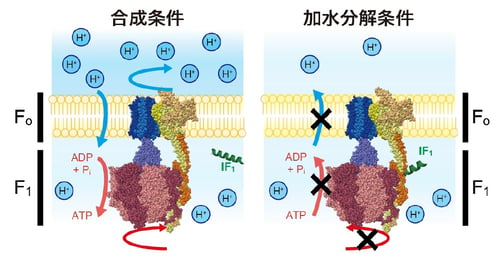
図1:ATP合成酵素とIF1の作用条件
〈研究の内容〉
上述の背景のもと、本研究グループは光学顕微鏡を用いてF1の回転を観察する1分子回転観察法によりIF1解離反応の解析を試みました。F1モーター単体では、ATPを加水分解しながら反時計回り方向に回転します。そこにIF1を加えると、F1モーターの回転が停止します。外部から力を加えない条件では、IF1阻害状態のF1は停止したままで自発的に回転を再開することはありませんでした。そこで、磁気ピンセットを用いてF1の回転子に結合した磁気ビーズに磁場をかけることで、停止状態のF1を強制的に回転させてその後の運動を観察しました(図2)。
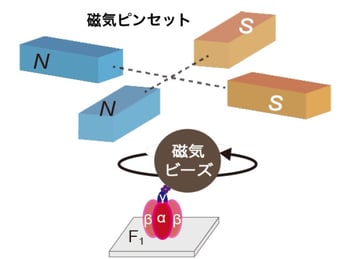
図2:実験模式図
ガラス面に固定したF1の回転子に目印となる磁気ビーズ(サイズ約300 nm)をつけて、回転を観察する。顕微鏡上には2組の電磁石対からなる磁気ピンセットを取り付け、外部制御により自在に磁場を発生させる。これにより、F1の動きを操作することができる。
その結果、停止したF1を時計回り方向に回転させるとIF1が外れる現象が観察されました。加水分解時にF1は反時計回り方向に回転することを考えると、IF1解離にはF1の自律的な反時計回り回転とは逆方向の回転が必要であることを意味しています。また、溶液中にADPと無機リン酸(Pi)が存在する場合は高い確率で回転が再開することを発見しました(図3)。
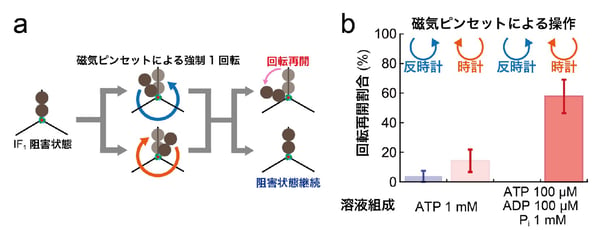
図3:磁気ピンセットによる強制操作実験
(a) 実験の模式図。停止状態から強制的に操作された粒子は回転を再開するか、停止状態を継続するかのどちらかの挙動を示す。(b) 4通りの実験条件での回転再開割合の比較。
これらの観察結果は、ATP加水分解条件ではIF1阻害は解除されにくく、ATP合成環境になるとIF1が解離しやすいことを意味しており、IF1が無駄な加水分解を抑制するために働くという生化学的な要求に合致しています。つまり、F1の回転方向に依存したIF1の解離機構が明らかになりました。次に、IF1による厳密な反応制御機構にはどのような相互作用が必須かを検証するために、本研究グループはIF1を構成するアミノ酸を段階的に削除した変異体を作成し、同様の実験を行いました。その結果、回転方向依存的な制御にはF1モーターの回転子と留め金として働くIF1の間の相互作用が重要であることを突き止めました(図4)。
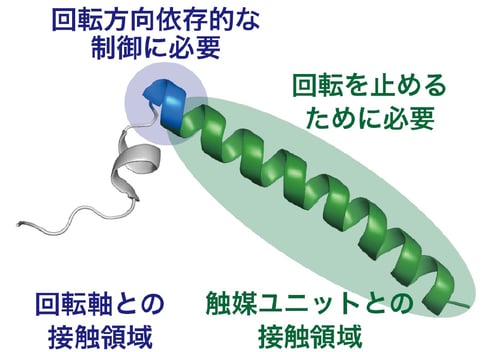
図4:IF1のアミノ酸残基ごとの役割
〈今後の展望〉
本研究では、ミトコンドリアATP合成酵素の制御因子であるIF1は、F1モーターの回転方向に依存した解離機構を持つこと、その起源はF1モーターの回転子とIF1の接触であることが明らかになりました。ATP合成酵素の制御にはIF1だけではなく、種によってさまざまな制御機構が存在しています。回転分子モーターの動きをコントロールする制御因子の分子メカニズムを明らかにした今回の研究は、既存の制御因子による作用機序の理解が進むだけではなく、得られた知見をもとにした新たな制御因子のデザイン・創成につながると期待されます。
発表者
東京大学大学院工学系研究科応用化学専攻
野地 博行(教授)
上野 博史(講師)
小林 稜平 (特任研究員:研究当時)
<現所属:分子科学研究所計算科学研究センター(日本学術振興会特別研究員)>
分子科学研究所計算科学研究センター
岡崎 圭一(准教授)
論文情報
〈雑誌〉Nature Communications
〈題名〉Molecular mechanism on forcible ejection of ATPase inhibitory factor 1 from mitochondrial ATP synthase
〈著者〉Ryohei Kobayashi, Hiroshi Ueno, Kei-ichi Okazaki, and Hiroyuki Noji*
〈DOI〉10.1038/s41467-023-37182-9
〈URL〉https://www.nature.com/articles/s41467-023-37182-9
研究助成
本研究は、科研費「基盤S(課題番号:JP19H05624、研究代表者:野地博行)」、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)(課題番号:RGP0054/2020)、日本学術振興会(JSPS)科学研究費助成事業 新学術領域研究(研究領域提案型)(課題番号:19H05380・21H00388、研究代表者:上野博史)の支援を受けて行われました。
用語解説
(注1)膜電位:
膜の内外に存在する電位差のこと。細胞では膜の内外で存在するイオンの種類・組成が異なることで電位の差が発生する。
(注2)プロトン駆動力:
膜間に生じる膜電位とプロトン(H+)の濃度差からなる。これら2つの要素の組み合わせによって膜を越えたプロトンの移動方向が決定される。
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-023-37182-9
おすすめ記事
本件に関連する記事はこちら