1.発表者:
大平 高之(東京大学 大学院工学系研究科 化学生命工学専攻 助教)
蓑輪 恵一(東京大学 大学院工学系研究科 化学生命工学専攻 博士課程3年生)
富田 耕造(東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
鈴木 勉 (東京大学 大学院工学系研究科 化学生命工学専攻 教授)
2.発表のポイント:
◆タンパク質はリン酸化と脱リン酸化によってその機能や細胞内における局在がダイナミックに制御されている。本研究は、タンパク合成のアダプター分子であるtRNA(注1)において可逆的なリン酸化修飾(2′リン酸化ウリジン, Up修飾)を発見した。Up修飾はtRNAに耐熱性やRNA分解酵素に対する耐性を与えることで、生物の耐熱性に寄与することを明らかにした。
◆ tRNAのX線結晶構造解析から、Up修飾は準安定なtRNAの立体構造を許容することでtRNAの熱変性を防ぐという、RNA修飾(注2)が担う新しい機能を提唱した。
◆ Up修飾を導入する酵素(ArkI)およびUp修飾を脱リン酸化する酵素(KptA)を同定し、Up修飾が可逆的であることを示した。Up修飾の可逆性は環境変化に応じてtRNAの構造と機能を調節することで生物の生存に寄与していると考えられる。
◆ 本研究成果は、RNAの構造と機能がリン酸化修飾によって、エピトランスクリプトミクス(注3)的に制御される新たな機構を提唱し、RNA修飾が担う生命の環境適応進化の理解に貢献する。
◆ RNAは医薬開発における新しいモダリティとして注目されている。特にmRNAワクチンをはじめsiRNAやアプタマーなどに代表される核酸医薬が次々と実用化されている。RNA修飾は、細胞内におけるRNA医薬の安定性や自然免疫の回避などの重要な機能が知られており、本研究で報告したUp修飾が将来的にRNA医薬に応用されることが期待される。
3. 発表概要:
東京大学大学院工学系研究科化学生命工学専攻の大平高之助教、蓑輪恵一大学院生、鈴木勉教授のグループは、超好熱性アーキア(注4)のtRNA(図1A)の可変ループ(注5)内の47位から新規のRNA修飾である2′リン酸化ウリジン(Up)(図1B) を発見した。生化学的な解析から、この修飾がtRNAに熱安定性に寄与し(図1C)、さらにRNA分解酵素に対する耐性を付与(図1D)していることを明らかにした。
Up修飾によるtRNA構造の安定化機構を解明するため、東京大学大学院新領域創成科学研究科メディカル情報生命専攻の富田耕造教授らと共同で、X線結晶構造解析を行い、アーキアtRNAの立体構造を1.9 Åの高分解能で決定した(図2A)。Up修飾は可変ループにフレキシビリティを与えると共に、主鎖の回転を防ぐことで“南京錠”のようにtRNAのコア領域(注6)が熱変性するのを防ぐ働きがあることが示された(図2B、C)。実際に、結晶構造の中に、Up修飾によって安定化された非標準的なコア構造を持つtRNA分子が見出されている(図2D)。すなわち、Up修飾が準安定なコア領域の構造を安定化することでtRNAの熱変性を防ぐという、これまでに知られていなかったRNA構造の安定化原理を見出した。
さらに研究グループは、Up修飾酵素(writer)(注7)としてArkIを同定し(図3A)、東京工業大学生命理工学院の福居俊昭教授らとの共同研究により、アーキアの遺伝学的な解析を行うことで、Up修飾が超好熱性アーキアの高温環境への適応に寄与していることを明らかにした(図3B、C)。
また、生化学的解析から、ArkIはタンパク質リン酸化酵素ファミリーに属する新規のRNAリン酸化酵素であり(図4A)、速度論的解析から、リン酸化反応の律速はATP濃度であり、細胞内のエネルギー状態を感知してUp修飾が導入される可能性が示唆された(図4B)。さらに、X線結晶構造解析により、ArkIの立体構造(1.8 Å)が解かれ(図4C)、活性中心の構造やRNAの認識に重要なアミノ酸残基が特定された(図4D)。
さらに、研究グループはUp修飾の脱リン酸化酵素(eraser)(注8)として、KptAを特定し(図5A)、速度論的解析から、KptAがtRNAからUp修飾を効率よく脱リン酸化する活性を有していることを突き止めた(図5B)。さらに、KptAが細胞内においてもUp修飾のeraserとして働くことを証明した(図5C、D)。この結果は、ArkIとKptAの両方を持つ生物種においてはtRNAの構造や機能がUp修飾によって可逆的に調節されている可能性を強く示唆する(図6)。
タンパク質や生体内のさまざまなメタボライトの機能や代謝が、リン酸化と脱リン酸化によって、ダイナミックに調節されていることは、生化学や分子生物学の基本的な概念として良く知られているが、RNAのリン酸化修飾は今日に至るまで見過ごされていた。本研究は、RNAの可逆的なリン酸化修飾を世界で初めて見出し、この修飾によってRNAの機能や構造が調節されること、さらには、極限環境生物の環境適応に寄与することを明らかにした。本研究成果は、RNA修飾によるエピトランスクリプトミックな遺伝子発現の調節機構の理解や、RNA修飾が担う生命の適応進化の理解に貢献するものである。本研究成果は4月27日(英国夏時間)に科学誌「Nature」のオンライン版に掲載されました。
4. 発表内容:
タンパク質合成(翻訳)は全ての生物に必須のプロセスである。tRNAは翻訳の過程でmRNA上の遺伝暗号(コドン)とアミノ酸を対応付けるアダプター分子として機能する。tRNAは転写後に多様な化学修飾を受けることで機能的に成熟する。これらの修飾は、tRNAの立体構造の安定化や、コドン解読の正確性に寄与している。従って、tRNA修飾の欠損や異常は遺伝子発現の破綻を招き、しばしば生育不良や疾患の原因となることが知られている。また、高温環境で生育する好熱性生物においてtRNA修飾はtRNAの耐熱性に関与しており、tRNA修飾の欠失した好熱性生物が高温感受性(高温下での生育低下や生育不能)を示す例が知られている。生育温度に応じて修飾率がダイナミックに変動するtRNA修飾も知られ、tRNAの固さやフレキシビリティを調節することで、生育温度における翻訳の最適化に寄与している。
研究グループは、超好熱性アーキアであるSulfurisphaera tokodaiiから複数種のtRNAを単離精製し、詳細な質量分析(RNA-MS)および生化学的な解析から、tRNAの可変ループ内の47位に、ウリジン(U)の2′位がリン酸化された新規RNA修飾、2′リン酸化ウリジン(Up)を発見した(図1A、 B)。Up修飾は、可変ループの長さが5塩基のすべてのtRNAに見られ、82~100%と非常に高い修飾率で導入されていた。
Up修飾がtRNA構造に与える効果を調べるため、Up修飾を持つtRNAと、Up修飾を酵素的に脱リン酸化したtRNAの熱融解温度(Tm値)を測定したところ、Up修飾を持つtRNAは持たないtRNAと比較して、Tm値で6.6℃も融点が高いことが判明した(図1C)。またRNA分解酵素に対する感受性を比較したところ、Up修飾はtRNAを分解酵素から保護する役割があることが判明した(図1D)。
次に、Up修飾によるtRNAの安定化機構を明らかにするため、単離したS. tokodaii tRNAVal3を結晶化し、X線結晶構造解析により、高分解能(1.9 Å)の立体構造を得た(図2A)。1つの格子中にコア構造の異なる2つのtRNA分子(Mol. AとMol. B)が観察され、どちらの構造においてもUpのリボースはC2′-endoコンフォメーション(注9)をとっていた。また、2′リン酸基は溶媒側に突出しており、反対にウラシル塩基はtRNAのコア領域側を向いていた(図2B)。通常、tRNAの47位は塩基部分が溶媒側を向いていることから、Upの2′リン酸基は主鎖の回転を制限することで塩基部分を内側に向けていることが示唆された(図2B)。Mol. A はtRNAの標準的なコア構造を持ち(図2D)、Ψ13-G22-G46から成るベーストリプルが形成されているが、Mol. BではこのベーストリプルからG46が離脱しUp47のウリジン塩基とスタッキングしていた(図2D)。また、抜けたG46の代わりに下層からC9が持ち上がり、Ψ13-G22-C9から成る新たなベーストリプルを形成していた(図2D)。tRNAが熱変性する際には、コア領域から崩壊することが知られており(図2D)、G46の離脱は、熱変性の中間状態とみなすこともできる。Up47は主鎖の回転を防ぐことで、G46を受け止め、準安定なコア構造を安定化しtRNAの熱変性を防いでいると考えられる(図2D)。また、Upを脱リン酸化したtRNAの結晶構造は標準的なコア構造を持つMol. Aのみで、Mol. Bは観察されなかった。Up修飾はtRNAを頑強に固めて安定化するのではなく、tRNAのコア構造の柔軟性をむしろ維持し、準安定な構造をとれるようにすることで、tRNAの熱変性を食い止める、言わば南京錠のような働きがあると言える(図2C)。このようなRNA修飾の機能は前例がなく、従来の常識を覆す発見である。
次に、Up修飾を持つ生物種の分布を調べ、その結果を基に比較ゲノム解析によるUp47の修飾酵素遺伝子の絞り込みを行った。その結果、機能未知のタンパク質リン酸化酵素が候補遺伝子として絞り込まれた。超好熱性アーキアであるThermococcus kodakarensisにおいて、この候補遺伝子の破壊株を作成し、LC/MS解析により修飾の有無を調べたところ、この株においてUp修飾が消失していることが判明した(図3A)。研究グループはこの遺伝子をarkI(Archaeal RNA kinase)と命名した。次に、Up修飾の生理的意義を調べるため、T. kodakarensisの野生株およびarkI遺伝子破壊株(ΔarkI )の生育を83℃、87℃、91℃条件下で比較したところ、ΔarkIは弱い高温感受性を示した(図3B)。さらにtRNAコア領域に剛直性を与えるアーケオシン(G+)修飾(図1A)に着目し、その生合成遺伝子であるqueEとarkIとの二重破壊株(ΔarkI/ΔqueE )を作成し生育を比較した(図3B)。その結果、ΔarkI/ΔqueEは87℃においてΔarkIよりも顕著な高温感受性を示し(図3B)、Up修飾がG+修飾と協調して超高温環境下での生育に必須の役割を担うことが判明した。Up修飾を“南京錠”に例えるなら、G+修飾はtRNAを剛直に固定する言わば“ネジ”のような働きがあり(図3C)、本研究から、tRNAが作用機構の全く異なる2つのtRNA修飾によって協調的に安定化されていることが明らかとなった。
ArkIの生化学的特性を明らかにするため、大腸菌発現系によりT. kodakarensis由来のArkI(TkArkI)を取得し、Up修飾の試験管内再構成実験を行った。その結果、TkArkIはATPをリン酸基供与体としてtRNAをリン酸化することが判明した(図4A)。反応速度論的解析から、TkArkIはtRNAを効率よく認識して(Km値97 nM)リン酸化を行う一方で、ATPに対するKm値は1.2 mMと非常に高く、ATPに対する親和性が非常に低いことが明らかとなった(図4B)。この結果は、Up修飾の律速は細胞内のATP濃度であり、TkArkI は細胞内のATP濃度を感知してtRNAをリン酸化することが示唆された。さらに、TkArkIを結晶化し、そのX線結晶構造を1.8 Åの解像度で取得した。TkArkIは2つのローブ(区画された領域)からなり、真核生物のタンパク質リン酸化酵素(ePK; Eukaryotic Protein Kinase)に類似していた(図4C)。TkArkI の活性中心には、ATP結合モチーフやリン酸基転移に関与するePKに保存されたモチーフが観察された。変異体解析によりこれらのモチーフに保存された残基が実際に活性に寄与することが判明した(図4E)。また、活性中心の周りは正電荷の表面で覆われており(図4D)、これらの正電荷はtRNAとの結合に必要であることが変異体解析から示唆された(図4E)。また、活性中心にはATPではなくグアノシンが結合していた(図4C)。この結合様式は想定されるATP結合様式とは異なっていることから、tRNAが結合するとATPのリン酸基を認識するモチーフが活性中心に配置され、ATPが結合できるようになると類推された。この知見はTkArkIがATPに対する高いKm値を持つことに説明を与えている。
最後に、Up修飾の可逆性について解析を行った。ArkIを持つ生物の一部には2′リン酸転移酵素であるKptAを持つものが存在することから、これら生物においてUp修飾は可逆的である可能性が示唆された。そこでT. kodakarensis由来のKptA(TkKptA)を取得し、生化学的および反応速度論的解析を行った。その結果、TkKptAはUp修飾を脱リン酸化する高い活性を持ち(図5A)、tRNAに対する親和性がTkArkIと同程度であることが判明した(図5B)。次に、KptAが細胞内で実際にUp修飾を脱リン酸化するかどうかを調べるため、大腸菌内でArkIを発現しtRNAにUp修飾を導入した状態で、TkKptAの発現を誘導したところ、Up修飾はTkKptAの発現に応じて減少し、KptAが細胞内で実際にeraserとして機能する事が示された(図5C、D)。この結果は、タンパク質の機能が可逆的なリン酸化によって調節されているように、tRNAも可逆的なリン酸化による機能調節を受けているというエピトランスクリプトミックな遺伝子発現調節機構の存在を示唆している(図6)。超好熱性アーキアのような極限環境生物において、Up修飾の可逆性は、tRNA構造の柔軟性を素早く変化させることで、急激な生育温度の変化などに速やかに適応することを可能にしている、と考えられる。
本研究は、日本学術振興会(JSPS)の基盤研究(S)「RNAエピジェネティックスと高次生命現象」(代表:鈴木 勉、26220205)、基盤研究(S)「RNA修飾の変動と生命現象」(代表:鈴木 勉、18H05272)、新学術領域研究(研究領域提案型)「ncRNAのケミカルタクソノミ」(代表:鈴木 勉、26113003)、基盤研究(A)「高次生命現象を制御する鋳型非依存的RNA合成酵素の構造と機能」(代表:富田 耕造、18H03980)、新学術領域研究(研究領域提案型)「ncRNA作動エレメントの配列構造の同定」(代表:富田 耕造、26113002)、若手研究(B)「tRNAの新規成熟経路の解析と5’キャップによる成熟制御機構の解析」(代表:大平 高之、26840005)、若手研究(A)「Pre-tRNA cappingが関与する遺伝子発現制御機構の探究」(代表:大平 高之、17H04997)、特別研究員奨励費「tRNA安定化に寄与するリン酸化修飾を触媒する新規酵素ARKIの分子機構の解明」(代表:蓑輪 恵一、19J20723)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木 勉、JPMJER2002)の支援を受けて実施された。
5.発表雑誌:
雑誌名:「Nature」
論文タイトル:Reversible RNA phosphorylation stabilizes tRNA for cellular thermotolerance
著者:Takayuki Ohira, Keiichi Minowa, Kei Sugiyama, Seisuke Yamashita, Yuriko Sakaguchi, Kenjyo Miyauchi, Ryo Noguchi, Akira Kaneko, Izumi Orita, Toshiaki Fukui, Kozo Tomita, and Tsutomu Suzuki
DOI番号:10.1038/s41586-022-04677-2
アブストラクトURL:https://www.nature.com/articles/s41586-022-04677-2
6.用語解説:
(注1)tRNA
Transfer RNA(転移RNA)。タンパク質合成において、コドン(遺伝暗号)とアミノ酸を対応させるアダプター分子として働く。70~90塩基長の短い一本鎖RNAで、二次構造としては特徴的なクローバー葉様構造をとり、それが折りたたまりL字型の立体構造を取る。tRNAは3′末端に対応するアミノ酸を受容し、20種類のアミノ酸に対応して異なるtRNA種が存在する。tRNAにはコドンと対合するアンチコドンを持ち、リボソーム上でmRNA(伝令RNA)上のコドンと結合することで、対応するアミノ酸を伸長中のタンパク質へと導入する。
(注2)RNA修飾
RNAは転写後に多様な化学修飾が酵素的に導入される。現在までに、およそ150種類のRNA修飾がさまざまな生物種から見つかっている。約80%のRNA修飾はtRNAから見つかったものである。アンチコドンとその近傍にあるtRNA修飾はコドンの解読精度やタンパク合成の効率に関わる。一方、コア領域に見られるtRNA修飾はtRNA全体の構造の安定化や耐熱性などに寄与する。
(注3)エピトランスクリプトミクス
RNAの構造や機能がRNAの転写後修飾によってダイナミックに制御されることで、遺伝子発現の調節を介して、さまざまな生命現象に関与するという概念。
(注4)超好熱性アーキア
地球上の全ての生物は原核生物、真核生物、アーキアの三界に分類することができる。アーキアは極限環境で生育するものが多く、特に80℃以上の温度で生育するアーキアを超好熱性アーキアと呼ぶ。超好熱性アーキアは進化系統樹の根本に位置することから、原始生命体に近いと考えられている。
(注5)可変ループ
tRNAのクローバー葉様構造には、部位ごとに名称があり(図1A)、可変ループはアンチコドンアームとTアームの間に位置する。
(注6)コア領域
tRNAの中心部分の構造を指す。Dアーム、Tアーム、可変ループから形成される。
(注7)writer
RNA修飾酵素の総称。RNA修飾を書き込むというニュアンスからこのように呼ばれる。
(注8)eraser
RNA脱修飾酵素の総称。writerによって書き込まれた修飾を消すというニュアンスからこのように呼ばれる。
(注9)C2′-endoコンフォメーション
糖の立体配座の1つ。
7.添付資料: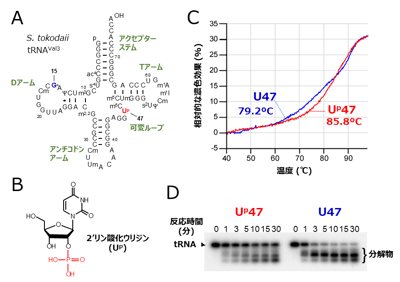 図1. Up修飾はtRNAに熱安定性およびRNA分解酵素に対する耐性を付与する
図1. Up修飾はtRNAに熱安定性およびRNA分解酵素に対する耐性を付与する
(A) S. tokodaii tRNAVal3の二次構造。47位のUp修飾を赤字、15位のアーケオシン(G+)修飾を青字で示した。
(B) 2′リン酸化ウリジン(Up)修飾の化学構造。
(C) S. tokodaii tRNAVal3の熱融解曲線。Up修飾を持つtRNA(Up47)と持たないtRNA(U47)をそれぞれ赤線と青線で示す。Up修飾を外したtRNAはTm値が6.6℃低下した。
(D) S. tokodaii tRNAVal3のRNA分解酵素に対する感受性。Up修飾を持たないtRNA(U47)は時間と共に速やかに分解するのに対し、Up修飾を持つtRNA(Up47)はRNA分解酵素に対して明確な耐性を示した。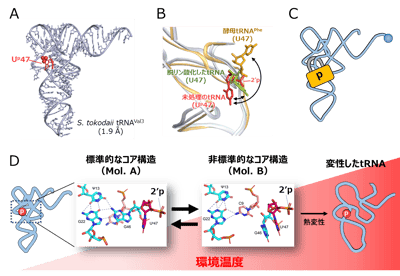 図2. Up修飾はtRNAの準安定なコア構造を安定化している
図2. Up修飾はtRNAの準安定なコア構造を安定化している
(A) S. tokodaii tRNAVal3のX線結晶構造(解像度1.9 Å)。Up修飾を赤で示す。
(B) コア領域の構造比較。未処理のS. tokodaii tRNAVal3(Up47、赤)、Up修飾を外したtRNA(U47、緑)、酵母tRNAPhe(U47、黄、PDB:1EHZ)を重ね合わせた。47位はBall and Stickで表示する。未処理のtRNAでは2′リン酸基が溶媒側を向き、ウラシル塩基がコア領域を向いている。
(C) Up修飾はtRNAにある程度の柔軟性を担保しながら主鎖の回転範囲を制限し、tRNAの崩壊を防ぐ南京錠のように働く。
(D) Up修飾によるtRNAコア領域の安定化モデル。tRNAの熱変性はコア領域の崩壊から始まることから、Ψ13-G22-G46から成るベーストリプルからのG46の離脱は、熱変性の中間状態とみなすことができる。Up修飾が主鎖の回転を制限することでコア構造の安定化に寄与するだけでなく、コアから解離したG46をスタッキングによって受け止め、Ψ13-G22-C9からなる準安定なコア構造を安定化することで熱変性によるtRNAの崩壊を防ぐとともに、再び標準的なコア構造に戻る機会を増やすと考えられる。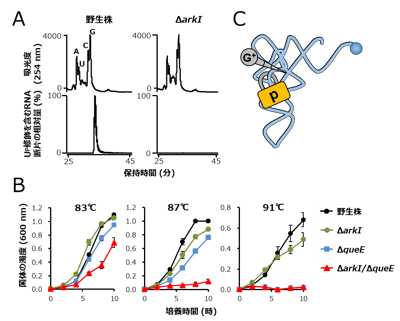 図3. Up修飾は超好熱性アーキアの高温適応に寄与する
図3. Up修飾は超好熱性アーキアの高温適応に寄与する
(A) LC/MS解析によるUp修飾の確認。上段はUV吸光度(254 nm)のクロマトグラム。下段はUp47を含む断片(pUpm5C、m/z 724)のマスクロマトグラム。左は野生株、右は候補遺伝子破壊株。候補遺伝子(ΔarkI )の破壊株でUp修飾が消失した。
(B) T. kodakarensis遺伝子破壊株の生育曲線(培養温度は83℃、87℃、91℃)。野生株(黒)、arkI遺伝子破壊株(ΔarkI、緑)G+修飾に関わるqueE遺伝子破壊株(ΔqueE、シアン)、arkI/queE二重遺伝子破壊株(ΔarkI/ΔqueE、赤)。arkIの単独遺伝子破壊株は弱い温度感受性を示し、二重遺伝子破壊株は顕著な温度感受性を示した。
(C) Up修飾がG+修飾と協働してtRNAを安定化するモデル。前述したようにUp修飾は柔軟性を許容しながらtRNAの崩壊を防ぐ南京錠のように働く一方で、G+修飾は周辺のヌクレオチドと多数の相互作用を形成することで、ネジのように堅くtRNAを安定化する。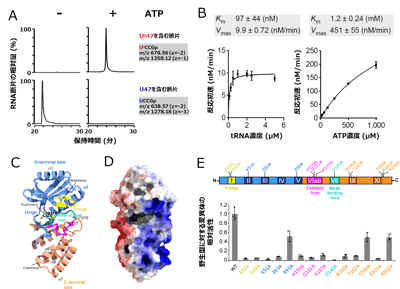 図4. ArkIはATP依存的なRNAリン酸化酵素である
図4. ArkIはATP依存的なRNAリン酸化酵素である
(A) 組換えTkArkIを用いた試験管内Up修飾再構成。上段はUp47を含むRNA断片のマスクロマトグラム。下段は未修飾のU47を含むRNA断片のマスクロマトグラム。左はATP未添加、右はATP添加時の結果を示す。
(B) TkArkIによるUp修飾形成の反応速度論解析。左はtRNA濃度に対する反応初速を計測し、tRNAに対するKm値、Vmax値を非線形解析で算出した。右はATP濃度に対する反応初速を計測し、ATPに対すKm値、Vmax値を同様に算出した。
(C) TkArkIのX線結晶構造(解像度1.8 Å)。モチーフや部分構造を色分けした。N-terminal lobeを青、C-terminal lobeをオレンジ、P-loopを黄色、Catalytic loopをピンク、Metal binding loopをシアンで示す。また、活性中心にはグアノシンが結合していた(緑のBall and Stickで示す)。二次構造の情報は黒字で併記した。
(D) TkArkIの表面電荷。寒色は正電荷、暖色は負電荷を示す。活性中心からC-terminal lobeにかけて正電荷の帯が見える。
(E) TkArkIの変異体解析。上はTkArkIのモチーフ構造と変異を導入した部位を表す。下は各変異体の活性。縦軸は野生型(WT)の活性の平均を1としたときの相対活性を示す。横軸は各アミノ酸をアラニンに置換した変異体を表す。各変異体について3回ずつ試行し、平均値を棒グラフ、標準偏差をエラーバー、各試行の値を点で表示した。11個の変異体で大きな活性の低下が見られ、これらのアミノ酸が活性に寄与していることが示された。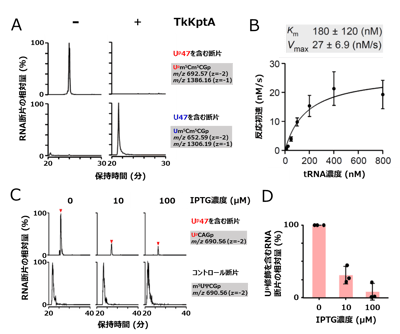 図5. KptAはUp修飾の脱リン酸化酵素である
図5. KptAはUp修飾の脱リン酸化酵素である
(A) 組換えTkKptAを用いた試験管内Up修飾の脱リン酸化反応。上段はUp47を含むRNA断片のマスクロマトグラム、下段は未修飾のU47を含むRNA断片のマスクロマトグラム。左はTkKptA未添加、右は添加時の結果を示す。
(B) TkKptAによるUp脱リン酸化反応の反応速度論解析。tRNA濃度に対する反応初速を計測し、tRNAに対するKm値、Vmax値を非線形解析で算出した。
(C) 大腸菌内でTkArkIを発現し大腸菌の内在のtRNAにUp修飾を導入した状態で、TkKptAの発現を異なるIPTGの濃度(0、10、100 μM)で誘導した。上段はUp47を含むRNA断片(UpCAGp)のマスクロマトグラム、下段はコントロールとして用いたRNA断片(m5UΨCGp)のマスクロマトグラムを示す。
(D) TkKptAの発現を異なるIPTG濃度で誘導した後、Up修飾を含むRNA断片(UpCAGp)を定量し、コントロールのRNA断片に対する相対値を棒グラフで示した。TkKptAの発現に応じてUp修飾が減少し、KptAが細胞内で実際にeraserとして機能する事が示された。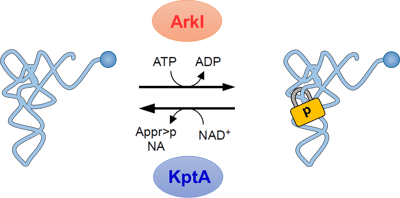 図6. ArkIとKptAによる可逆的なtRNAのリン酸化tRNAはwriterであるArkIによりUp修飾(南京錠のマークで示す)を導入されることでコア構造がロックされ安定となる。一方、eraserであるKptAがUp修飾を外すことでコア構造が柔軟になる。このような可逆的なRNAリン酸化によるtRNA構造の調節は、急激な温度変化といった環境変化に応じた遺伝子発現の調節に貢献していると考えられる。ArkIはATPをリン酸基ドナーとして用い、tRNAをリン酸化後、ADPが副産物として生じる。KptAはニコチンアミドアデニンジヌクレオチド(NAD+)をリン酸基アクセプターとして用い、Up修飾から脱離したリン酸基と反応するとADP-ribose 1′′,2′′-cyclic phosphate(Appr>p)とニコチンアミド(NA)が生じる。
図6. ArkIとKptAによる可逆的なtRNAのリン酸化tRNAはwriterであるArkIによりUp修飾(南京錠のマークで示す)を導入されることでコア構造がロックされ安定となる。一方、eraserであるKptAがUp修飾を外すことでコア構造が柔軟になる。このような可逆的なRNAリン酸化によるtRNA構造の調節は、急激な温度変化といった環境変化に応じた遺伝子発現の調節に貢献していると考えられる。ArkIはATPをリン酸基ドナーとして用い、tRNAをリン酸化後、ADPが副産物として生じる。KptAはニコチンアミドアデニンジヌクレオチド(NAD+)をリン酸基アクセプターとして用い、Up修飾から脱離したリン酸基と反応するとADP-ribose 1′′,2′′-cyclic phosphate(Appr>p)とニコチンアミド(NA)が生じる。
プレスリリース本文:PDFファイル
Nature:https://www.nature.com/articles/s41586-022-04677-2
おすすめ記事
本件に関連する記事はこちら
細菌の生存競争に関わるタンパク質の活性化の分子機構を解明 〜翻訳因子のこれまで知られていなかった新たな機能の発見〜
RNAのたった一か所のメチル化修飾がタンパク質におけるアミノ酸配列の多様性を生み出す~RNAスプライシング機構におけるm6A修飾の役割を解明~