1.発表者:
石神 宥真(研究当時:東京大学 大学院工学系研究科化学生命工学専攻 特任研究員/
現:Postdoctoral Fellow, Cold Spring Harbor Laboratory)
大平 高之(東京大学 大学院工学系研究科化学生命工学専攻 助教)
磯川 由衣(研究当時:東京大学 大学院工学系研究科化学生命工学専攻 修士課程2年)
鈴木 穣(東京大学 大学院新領域創成科学研究科メディカル情報生命専攻 教授)
鈴木 勉(東京大学 大学院工学系研究科化学生命工学専攻 教授)
2.発表のポイント:
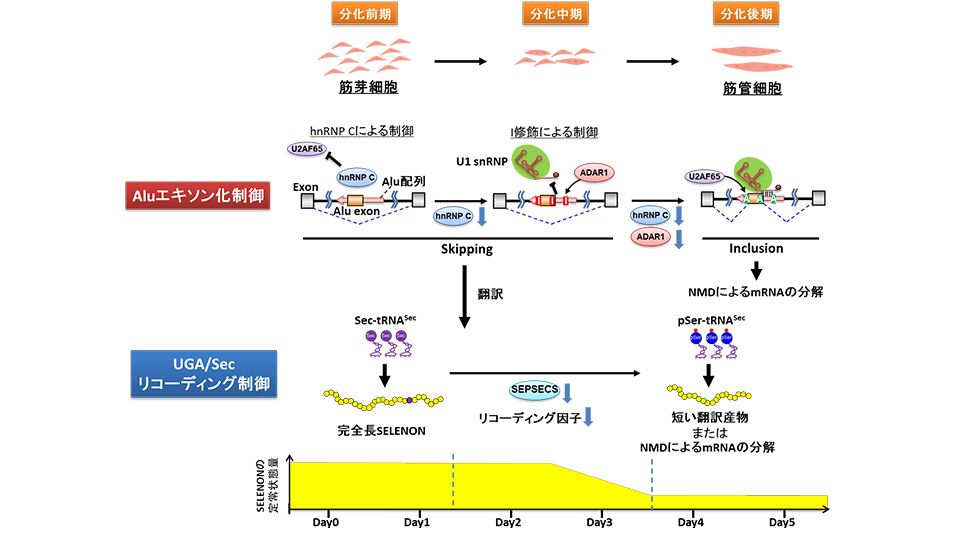
・様々な生命現象にかかわる N 6メチルアデノシン(m 6 A)修飾(注 1)が、遺伝子の転写後 に mRNA 前駆体が切断・連結されるスプライシング(注 2)において、重要な役割を演じ ていることを世界で初めて解明した。
・スプライソソーム(注3)とmRNA前駆体の相互作用において、U6 snRNA(注4)のm6A修飾が特定の塩基配列を持つイントロン(注5)との結合を安定化することで、スプライシングの効率を上げる仕組みを見いだした。この機構はU5 snRNAとエキソン(注6)間の相互作用が弱い時に、特に重要であることが判明した。
・ゲノム中に多数のイントロンを有する真核生物では、U6 snRNAのm6A修飾が5’スプライス部位におけるエキソン配列に自由度を与えることで、タンパク質のアミノ酸配列の多様性を許容する役割があると考えられる。
3.発表概要:
東京大学大学院工学系研究科化学生命工学専攻の石神宥真特任研究員(研究当時)と鈴木勉教授を中心とする研究グループは、U6 snRNA上のm6A修飾を欠損した分裂酵母株のトランスクリプトーム解析(注7)および遺伝学と生化学を駆使した解析により、mRNA前駆体のスプライシング反応におけるm6A修飾の役割を解明した。m6A修飾の欠損により、大きく影響を受けるイントロンの5’スプライス部位の配列の特徴から、m6A修飾はA-Aの塩基対合を強めることにより、U6 snRNAとイントロンの相互作用を安定化する役割があることが判明した。また、この相互作用は、U5 snRNAとエキソンとの相互作用が弱い時に、特に重要であることも判明した。この結果から、多数のイントロンを有する真核生物では、5’スプライス部位において、m6A修飾がU6 snRNAとイントロンの相互作用を安定化することで、U5 snRNAが認識するエキソン配列に自由度を与え、タンパク質のアミノ酸配列の多様性を許容する役割があると考えられる。
本研究は、その発見から40年以上謎に包まれていたU6 snRNA上のm6A修飾の役割を解明しただけでなく、スプライソソームの重要な構成因子であるU5 snRNAとU6 snRNAが協調的にmRNA前駆体を認識することの機能的な重要性を明らかにした。また多数のイントロンを獲得し、mRNAスプライシングを変化させることで複雑な生命現象を実現した高等真核生物の進化において、RNA修飾の役割を初めて明らかにした研究成果である。将来的には、RNA修飾とmRNAスプライシングの関係をより深く理解することで、遺伝子発現調節機構の探究や、ヒトの疾患の発症機構の解明につながることが期待される。本研究成果は5月28日(金)に科学誌「Nature Communications」に掲載されました。
4.発表内容:
RNAはDNAに記された遺伝情報をタンパク質へと変換する役目を担う重要な生体高分子である。さらに、RNA は遺伝子発現を転写や翻訳の各段階で複雑に制御する機能を持ち、さまざまな生命現象に関与することが明らかになりつつある。RNA は転写後に多種多様な修飾を受けて成熟し、その本来の機能を発揮することが知られている。現在までに約150種類のRNA修飾がさまざまな生物種から見つかっている。最近はRNA修飾の研究をエピトランスクリプトミクスと呼び、転写後段階における新しい遺伝子発現調節機構として、生命科学に大きな潮流を生み出している。N6-メチルアデノシン(m6A)は、真核生物のmRNAをはじめ種々のRNAに存在することが知られている。m6A修飾は、RNAの安定性や翻訳に関与することで遺伝子発現を調節し、減数分裂、性決定、概日周期、細胞の増殖・分化・初期化など多くの生命現象に関わっていることが明らかにされつつある。
真核生物において、DNAにコードされたタンパク質遺伝子のアミノ酸配列の情報はエキソンと呼ばれる遺伝子断片に記されており、エキソンとエキソンの間には翻訳されないイントロンと呼ばれる配列が介在している。タンパク質遺伝子はmRNA前駆体として転写された後に、スプライシングと呼ばれる反応によってエキソンとイントロンの間が切断され、イントロンが取り除かれたのちに、エキソン同士が連結されることで成熟したmRNAが完成する。このスプライシング反応は、核内低分子RNAである複数のU snRNA(U1, U2, U4, U5, U6 の5種類のU snRNAから成る)と多数の関連タンパクが形成するスプライソソームと呼ばれる巨大な複合体の中で進行する。スプライシング反応の第一段階では、mRNA前駆体5’スプライス部位が切断されるが、この切断部位を正確に決めるために、U5 snRNAがエキソン側を、U6 snRNAがイントロン側を認識することが重要である。U6 snRNAにはRNA触媒の活性があり、スプライシング反応において中心的な役割を担う。U6 snRNAには複数のRNA修飾が含まれているが、5’スプライス部位を認識するACAGAボックス(注8)と呼ばれる領域にm6A修飾を一か所持つことが知られている。このm6A修飾は哺乳動物から分裂酵母に至る幅広い真核生物で保存されていることから機能的な重要性が予測されていたが、スプライシング反応においてどのような役割を担っているかは不明であった。
本研究グループは、分裂酵母においてU6 snRNAにm6A修飾を導入する酵素(Mtl16)を同定した。この酵素の破壊株(mtl16Δ)は、DNA損傷に対する感受性の増加、高塩濃度条件に対する耐性の低下、ミトコンドリア活性の低下などを示し、U6 snRNAのm6A修飾の生理学的な重要性が示唆された。
m6A修飾の機能を解析するために、mtl16Δ株の大規模なトランスクリプトーム解析を行い、全mRNAを対象としたスプライシングに与える影響を観察した。その結果、mtl16Δ株においてスプライシング効率が顕著に低下し、mRNA中に保持されたイントロンを多数発見した(図1A)。一定以上のリード数をもって検出されたイントロンを対象にスプライシング効率を評価するスコアを計算し、m6A修飾の欠損でより強く影響を受けたものと、影響を受けなかったものについて5’スプライス部位周辺の配列を比較したところ、強く影響を受けたイントロンは、4番目の残基にアデノシン(A)を有すること(A4イントロン)が判明した(図1B)。スプライソソームの複合体B(B complex)において、イントロンの4番目の残基はU6 snRNAのACAGAボックスが5’スプライス部位を認識した際にm6Aと直接対合する位置にある(図1B)ことから、m6A修飾がA-Aの対合を安定化すると考えられた。次に、スプライソソーム中のU6 snRNAとA4イントロンの相互作用を模したヘアピンRNAを作成し、m6A修飾の有無と4番目の残基の違いによる熱安定性を計測した。その結果、イントロン4番目がAである場合に、m6A修飾がA-A対合を安定化する効果があることが判明した。さらに、レポーター遺伝子を作成し、イントロンの4番目の塩基を置換して、野生株とmtl16Δ株においてスプライシング効率を比較したところ、U6 snRNAのm6A修飾はA4イントロンのスプライシング効率を向上させる機能があることが判明した。
A4イントロンの中でm6A修飾の欠損がスプライシングに与える影響を詳しく解析したところ、エキソン側のトリプレット配列(position -1から-3)がAAG配列に類似しているほど、影響を受けにくいことが判明した(図1B)。エキソンのトリプレット配列AAGは、U5 snRNAのループIと呼ばれる領域と相補的であり、この配列を有するA4イントロンはU5 snRNAと安定に結合できるためにm6A修飾が欠損してもスプライシング効率が低下しないと考えられた。実際に、mtl16Δ株にレポーター遺伝子を導入しA4イントロンのトリプレット配列をAAG配列に近づけるほど、スプライシング効率が大きく向上した。さらに、変異したトリプレット配列と相補的なループIを持つU5 snRNAを発現させることで、m6A欠損により低下したスプライシングが一部改善することが判明した。
以上の結果から、A4イントロンにおいて、5’スプライス部位のエキソン側トリプレット配列をU5 snRNAが強く認識できる場合はU6 snRNAのm6A修飾の有無にかかわらずスプライシングが効率よく進行するが、エキソンとU5 snRNAの相互作用が弱い場合m6A修飾が無いとU6 snRNAがイントロンを安定に認識できずに、スプライシングが効率よく行われないというモデルが提唱された(図2)。このことは、スプライソソームがmRNA前駆体を認識する際にU5 snRNAとU6 snRNAが協調して5’スプライス部位を認識することを意味している。図3では今回のモデルを車の運転に例えた。A4イントロンの5’スプライス部位をハンドルに例えると、U5 snRNAが左手、U6 snRNAが右手であり、どちらか一方の手がハンドルをしっかりと握っている場合は安全な運転が可能であるが、ハンドルから両手を同時に離すと車の制御ができなくなる。
ゲノムにおけるイントロンの総数は、高等真核生物において増加傾向がみられる。ヒトには20万個、植物には12万個、線虫は10万個、分裂酵母でも約5000個のイントロンが存在する。これらの生物には共通してm6A修飾酵素であるMETTL16あるいはそのホモログ(相同体)を持ち、U6 snRNAにm6A修飾を有する。一方で、出芽酵母(300個)やシゾン紅藻(27個)など、イントロンの総数が少ない生物ではU6 snRNAにm6A修飾がないことが知られている。イントロンの数が増加するにつれて、エキソンのトリプレット配列に制約があると、タンパク質のアミノ酸配列に自由度が制限されることから進化的には不利に働くと考えられる。U6 snRNAにm6A修飾を獲得することで、5’スプライス部位におけるエキソンのトリプレット配列に自由度を与え、タンパク質のアミノ酸配列の多様性を許容する役割があると考えられる。本研究は、RNAスプライシングにおけるm6A修飾の新たな機能を明らかにし、エピトランスクリプトミクス研究のみならず真核生物ゲノムの進化を理解する上でも新たな視点を提供している。
本研究は、日本学術振興会(JSPS)の基盤研究(S)「RNA修飾の変動と生命現象」(代表:鈴木 勉、18H05272)、特別研究員奨励費「新規N6-メチルアデノシン修飾酵素の機能解析」(代表:石神 宥真、18J13582)、新学術領域研究「先進ゲノム解析研究推進プラットフォーム」(代表:鈴木 穣、16H06279)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木 勉、JPMJER2002)の支援を受けて実施された。
5.発表雑誌:
雑誌名:「Nature Communications」
論文タイトル:A single m6A modification in U6 snRNA diversifies exon sequence at the 5’ splice site
著者:Yuma Ishigami, Takayuki Ohira, Yui Isokawa, Yutaka Suzuki, Tsutomu Suzuki
6.用語解説: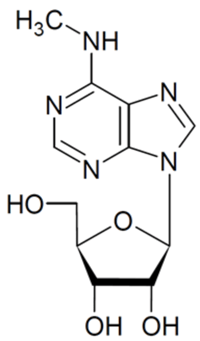
(注1)N6メチルアデノシン(m6A)修飾
アデニン塩基のN6位のアミノ基(-NH2)の水素のうち片方がメチル基(-CH3)によって置換されたRNA修飾。真核生物の様々なRNAに含まれるメジャーなRNA修飾の一つである。ヒトにおいては伝令RNA(mRNA)をはじめ、ウリジンリッチ核内低分子RNA(U snRNA)を含む様々なnon-coding RNA(タンパク質をコードしないRNA)に存在する。ライター(Writer)と呼ばれるRNAメチル化酵素がSAM(S-アデノシルメチオニン)を基質にメチル基を導入する。m6A修飾により、RNA間の相互作用が調節され、構造変化が誘起される。mRNA上のm6A修飾はリーダー(Reader)と呼ばれるRNA結合タンパクに認識されることで、その情報が読み取られるため、様々な生命現象に関与することが近年の研究により明らかになってきている。
(注2)スプライシング
真核生物のゲノムDNAにコードされたタンパク質遺伝子は、最終的にアミノ酸配列に変換され得る領域(エキソン)と、取り除かれる部分(イントロン)が交互に並んで構成されている。これらの配列はmRNA前駆体として転写されたのちに、エキソンとイントロン間の結合が切断されてイントロンが取り除かれた後に、エキソン同士がつながることで成熟したmRNAが生じる。この一連の反応をRNAスプライシングと呼ぶ。化学的には2回のリン酸エステル転移反応が進行する。
(注3)スプライソソーム
mRNA前駆体のスプライシングを行う複合体のこと。エキソンとイントロンの境界(5’スプライス部位)とイントロンとエキソンの境界(3’スプライス部位)周辺に、U1, U2, U4, U5, U6 snRNAと呼ばれる5種の核内低分子RNAと多数の関連タンパク質が結合することで、mRNA前駆体の認識とスプライシング反応の進行とともに次々と構成因子を変える複合体が形成される。この一連の反応において出現する複合体を総称してスプライソソームと呼ぶ。はじめに5’スプライス部位をU1 snRNAが、イントロンのブランチ部位(のちにイントロンの5’端が結合する)をU2 snRNAが認識する。次に5’スプライス部位のエキソン側をU5 snRNAが、イントロン側をU6 snRNAが認識する。
(注4)U6 snRNA
ウリジンリッチ核内低分子RNAの一種であり、RNAスプライシングを担うスプライソソームの構成要素。mRNA前駆体の5’スプライス部位のイントロン側と対合することで認識する。U6 snRNAのリン酸骨格が2個のマグネシウムイオンを配位することで、2回のエステル転移反応を触媒する。
(注5)イントロン
スプライシングに際して取り除かれるRNA領域。
(注6)エキソン
スプライシングによってイントロンが取り除かれた後、互いに連結され残されるRNA配列。アミノ酸配列情報を保持しタンパク質に翻訳される配列はすべてエキソンに含まれる。
(注7)トランスクリプトーム解析
細胞に発現している全RNAを大量に配列解析することで、どの遺伝子がどの程度発現しているかを知るための解析技術。得られたRNA配列(リード)をリファレンスとしてのゲノムDNA配列にマッピングし、統計処理を行うことで、遺伝子発現のプロファイルやスプライシングの状態を知ることができる。本研究ではポリAテールを持つmRNAを濃縮し、cDNAへ変換した後に次世代シーケンサーを用いて配列解析を行った。
(注8)ACAGAボックス
U6 snRNAの内部にあるACAGAという並びのRNA配列。スプライシングの際に5’スプライス部位のイントロンと塩基対合を形成することが知られていた。この配列の中央のAがm6A修飾されている。
7.添付資料:
(A)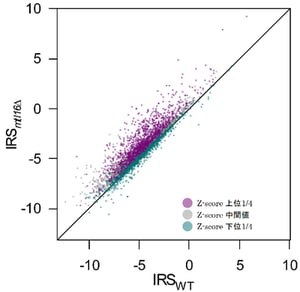
(B)
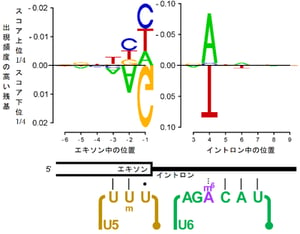 図1 U6 snRNAのm6A修飾の欠損は多くのイントロンのスプライシング効率を低下させる
図1 U6 snRNAのm6A修飾の欠損は多くのイントロンのスプライシング効率を低下させる
(A)一定以上のリード数をもって検出された全イントロンの保持状態を野生株とmtl16Δ(破壊)株の間で比較した散布図。点一つがイントロン一つを表し、mRNAに保持された割合が高いほどIRS(Intron Retention Score)の値が大きくなるため、対角線から左上にあがるほどmtl16Δ株においてイントロン保持の割合が高くなることを示す。欠損の影響を受けた度合い(Z-score)を計算し、降順に並べた際に、上位1/4のスコアに該当するイントロン群を紫で、下位1/4を緑で、残りのものを灰色で表した。
(B)散布図(A)において、紫色で示されたスプライシング変化の大きいイントロン群と緑色で示された変化の小さいイントロン群の間で、5’スプライス部位における各残基の出現頻度を比較した。変化の大きいイントロン群は小さい群と比べ4残基目のAの出現頻度が高くTの出現頻度が低いこと、またエキソン側のトリプレット配列ではAAGの出現頻度が低いことが示されている。
野生株(WT) m6A修飾欠損株(mtl16Δ)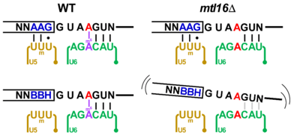 図2 U5, U6 snRNAによる5’スプライス部位の認識とm6A修飾による効果
図2 U5, U6 snRNAによる5’スプライス部位の認識とm6A修飾による効果
スプライソソームの複合体Bにおいて、A4イントロンの5’スプライス部位をU5 snRNAおよびU6 snRNAが認識している。U5 snRNAループIのUUmU配列が、エキソン側のトリプレットAAG配列を認識し、U6 snRNAのACAGAボックスがイントロン側と対合する。野生株においてm6A修飾はACAGAボックスとA4イントロンの塩基対合を熱力学的に安定化させるため、U6 snRNAはイントロン側と安定に結合できる。m6A修飾欠損株では、この結合が不安定になるが、エキソン側のトリプレットがAAG配列の場合は、U5 snRNAのループIが安定に結合できるため、スプライソソームは5’スプライス部位を安定に認識できる。一方で、エキソン側のトリプレットがBBH配列(BはA以外、HはG以外を示す)の場合は、U5 snRNAが安定に結合できないため、U6 snRNAがm6A修飾によってイントロン側と安定に結合することが、A4イントロンの効率的なスプライシングに重要な役割を担っている。したがって、m6A修飾欠損株では、BBH配列を持つA4イントロンのスプライシング効率が低下する。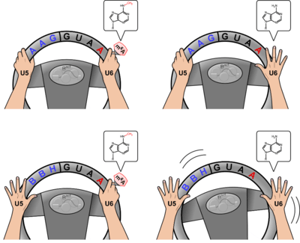 図3. U5、U6 snRNAによる5’スプライス部位の認識モデル
図3. U5、U6 snRNAによる5’スプライス部位の認識モデル
左手はU5 snRNA、右手はU6 snRNA、ハンドルはA4イントロンの5’スプライス部位をそれぞれ表す。エキソン側のトリプレットをAAGまたはBBHで表記し、イントロン側はGUAA配列が表記されている。右手のU6 snRNAに指輪で表現されたm6A修飾がある場合は、左手のU5 snRNAがハンドルを離していても、右手がしっかり握っている(左下)。m6A修飾がない場合でも、左手のU5 snRNAがハンドルを握っている場合はスプライシングが効率よく進行する(右上)が、左手を離した場合には両手を離した状態になり、ハンドルの制御ができず、スプライシングの効率が低下する(右下)。
プレスリリース:PDFファイル
日本経済新聞:https://www.nikkei.com/article/DGXLRSP611247_Y1A520C2000000/
Nature Communications:https://www.nature.com/articles/s41467-021-23457-6
おすすめ記事
本件に関連する記事はこちら
メチルは端だが役に立つ? ―mRNAのキャップ構造におけるm6A修飾酵素の同定―
生物の耐熱性を支える「錠前」の発見 ~可逆的なリン酸化修飾がRNAを安定化する~