1.発表者:
山口 哲志(東京大学 大学院工学系研究科 化学生命工学専攻 准教授)
岡本 晃充(東京大学 大学院工学系研究科 化学生命工学専攻 教授)
小阪 高広(東京大学 大学院工学系研究科 化学生命工学専攻 博士課程)
2.発表のポイント:
◆水中での選択的な光反応を介して、アジド基を導入した望みの分子を、光を照射した場所にのみ結合できる基材表面を開発した。
◆細胞表面と結合する分子を基材表面上の光を照射した場所に結合させることにより、その分子の性質に応じて、iPS細胞やがん細胞、免疫細胞など、幅広い種類の細胞を望みの場所に配置できた。
◆がん細胞と免疫細胞が一つずつ隣接するように光で配置することにより、免疫細胞ががん細胞を殺傷する様子を1細胞ずつ観察し、解析できた。このような技術は、がん免疫療法の効果を高める薬や治療用免疫細胞の開発に貢献すると考えられる。
3.発表概要:
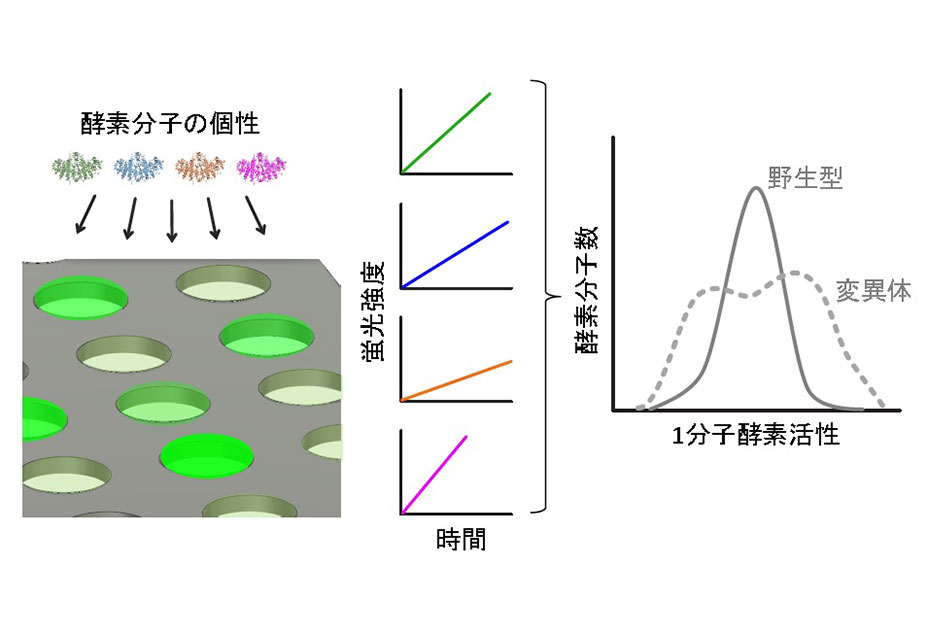
近年の1細胞解析(注1)の進歩により、細胞の基礎研究や創薬、診断において、細胞集団の中の個々の細胞の性質のバラつき(不均一性)が重要であることが分かってきた。そこで、これまで調べることができなかった個々の細胞の性質を調べる技術の拡充が必要とされている。
今回、東京大学大学院工学系研究科化学生命工学専攻の山口哲志准教授、岡本晃充教授、小阪高広大学院生らの研究グループは、産業技術総合研究所の舘野浩章グループ長と聖路加国際大学の山平真也卓越研究員との共同研究により、細胞同士の相互作用を1細胞ずつ観察するための新しい材料を開発した(図1A)。この分子は、親水性のポリマーに光反応性の構造が結合している。この分子を表面に修飾した基材に光を照射すると、アジド基(注2)を導入した分子を結合できるようになる(図1B)。そこで、細胞と付着する分子を結合させると、光照射位置にのみ細胞が付着する(図1C)。光照射と分子修飾、細胞付着の工程を隣接する位置で繰り返すと、異なる種類の細胞のペアを並べることができ、両者の細胞間相互作用を1細胞ずつ観察することができる(図1D)。従来の光応答性細胞付着表面と異なり、この表面では、配置したい細胞の種類や目的に応じて、細胞と付着する分子を自由に変えることができる。PEG脂質(注3)を結合すれば、どんな種類の細胞も瞬時に付着でき、一方、特定のレクチン(注4)を結合すれば、細胞の混合液の中からiPS細胞(注5)を選択的に付着することもできた。また、二種類の細胞のペアを高密度に配置する技術を確立後(図2A)、免疫細胞(注6)とがん細胞との相互作用を観察し、免疫細胞のがん細胞を殺傷する性質の不均一性を1細胞ずつ調べることにも成功した(図2B,C,D)。この成果は、さまざまな種類の細胞間の相互作用を一つずつ調べて、その不均一性や特徴のある細胞を検出できるため、がんや感染症、神経疾患などの細胞間相互作用が関わる病気の診断や治療法の開発に貢献することが期待される。
本研究成果は、2022年9月20日(米国東部夏時間)に米国化学会誌「Journal of the American Chemical Society」のオンライン版に掲載され、Supplemenatary Coverに採択された。
4.発表内容:
異種細胞間での接触を介した相互作用が、幅広い生命システムにおいて個々の細胞の性質を制御している。そのため、細胞間相互作用の1細胞解析が、疾病やその治療に関わる未知の情報を明らかにできると期待されている。そこで、近年、個々の細胞間相互作用の全容を明らかにするために、膨大な数の異種細胞の1細胞ペアを調製して、網羅的に観察する技術が盛んに研究されている。これまでに、MEMS技術(注7)を用いて調製した細孔やマイクロ液滴(注8)の中に異種細胞のペアを一つずつ閉じ込めて、その相互作用を観察する先駆的な技術が報告されてきた。しかし、解析できる細胞の種類に制限があり、微細空間に閉じ込めた状態で解析することによる影響も懸念される。
今回、本研究グループは、光反応性の材料を用いて異種細胞の1細胞ペアを大量に並べ、一般的な細胞観察用培養皿と同じ平面基材上で、その相互作用を観察する技術を開発した。まず、親水性のポリマーであるポリエチレングリコール(PEG)の片方の末端に、光活性化型のdibenzocyclooctyne(DBCO)前駆体を結合し、もう片方の末端で基材表面に修飾できる分子を合成した(図1A)。この前駆体に紫外光(波長360 nm)を照射すると、DBCOに変換されることが報告されている。ここで、DBCOは八員環に炭素-炭素三重結合(アルキン)を有する構造であり、温和な条件下でその「歪んだアルキン」構造にアジド基が選択的に反応して付加する。従って、この分子を修飾した基材に紫外光を照射すると、アジド基を修飾した任意の分子を、生理条件の水溶液中で連結できる(図1B)。そこで、光の微細パターンを基材表面に照射した後、アジド基を修飾したPEG脂質を作用させ、血球系の浮遊細胞を播種したところ、光照射領域にのみ細胞が付着した。同様に、細胞表層の特定の糖鎖に結合するレクチン(rBC2LCN)にアジド基を修飾して作用させたところ、その糖鎖を表面に持つiPS細胞が光照射領域に付着した。その際に、その糖鎖を表面に持たないヒトT細胞株であるJurkat細胞との混合懸濁液を播種したが、Jurkat細胞は付着せずにiPS細胞のみが選択的に付着した。また、上皮系がん細胞がその表層に発現する抗原(Epiregulin)に対する抗体を用いることにより、ヒト結腸腺癌HCT116細胞を光照射位置に配置することにも成功している。このように、細胞表面と付着する分子を用いて、さまざまな細胞を基材表面の望みの位置に配置できることが示された。さらに、①光照射と②細胞付着分子の修飾、③細胞の付着、の三つの工程を繰り返すことで、同一表面上に複数種類の細胞を望みのタイミングで配置できた。そこで、細胞一つ分の大きさの光のスポットをスライドガラス上に均一に約5000か所以上照射できる自動照射装置を用い、二種類の細胞を一つずつ隣接するように配置する技術を確立した(図2A)。この技術を用いて、ヒトの血液検体に含まれるナチュラルキラー細胞(NK細胞)(注9)とヒト慢性骨髄性白血病由来のK562細胞とのペアを配置し、直ちに両者の相互作用を経時観察した(図2B,C)。その結果、個々のNK細胞がK562細胞を殺す様子をリアルタイムで顕微鏡観察でき、その不均一性を確認できた(図2D)。さらに、経時変化画像の特徴から、細胞死誘導のメカニズムについても類推できた(図2D)。
第4のがん治療法として、免疫細胞によってがん細胞を選択的に殺傷して治癒するがん免疫療法が注目されている。本技術は、がん細胞傷害性の高い免疫細胞を膨大な量の候補細胞の中から識別できるため、治療用のTCR-T細胞(注10)の選別や、CAR-T細胞(注11)の品質管理に貢献することが期待される。また、特徴的な細胞間相互作用を示す細胞を1細胞レベルで識別できるため、その細胞表層のタンパク質を調べることで、新しい治療や診断用の標的分子の発見にもつながると期待される。
本研究は、JST「未来社会創造事業(課題番号:19217334)」(研究代表:山口哲志)、JSTさきがけ「統合一細胞(課題番号:16815021)」(研究者:山口哲志)、日本学術振興会「特別研究員奨励費(課題番号:20J22920)」(研究者:小阪高広)の支援により実施された。
5.発表雑誌:
雑誌名:「Journal of the American Chemical Society」(オンライン版:9月20日)
論文タイトル:Bioorthogonal Photoreactive Surfaces for Single-Cell Analysis of Intercellular Communications
著者:Takahiro Kosaka, Satoshi Yamaguchi, Shin Izuta, Shinya Yamahira, Yoshikazu Shibasaki, Hiroaki Tateno and Akimitsu Okamoto
DOI番号:10.1021/jacs.2c07321
URL:https://pubs.acs.org/doi/10.1021/jacs.2c07321
6.研究グループの構成:
小阪 高広(東京大学 大学院工学系研究科 化学生命工学専攻 博士課程)
山口 哲志(東京大学 大学院工学系研究科 化学生命工学専攻 准教授)
泉田 森(研究当時:東京大学大学院工学系研究科 化学生命工学専攻 修士課程)
山平 真也(聖路加国際大学 医科学研究センター 卓越研究員)
柴崎 芳一(研究当時:東京大学 先端科学技術研究センター 教授/現所属:東京工科大学大学院 臨床検査学専攻 教授)舘野 浩章(産業技術総合研究所 細胞分子工学研究部門 グループ長)
岡本 晃充(東京大学 大学院工学系研究科 化学生命工学専攻 教授)
7.用語説明:
(注1)1細胞解析:
単一細胞解析、シングルセル解析とも言う。個々の細胞の遺伝子発現やゲノムDNAの状態を解析することを意味していたが、現在では、1細胞レベルで細胞を解析することを全般的に表す。このような解析により、これまでは均一だと思われていた同種の細胞集団の中でも、個々の細胞の性質にはさまざまなバラつきがあることが分かってきた。
(注2)アジド基:
窒素原子が直線状に三つ結合した官能基(原子団)。アルキンと環化付加反応を起こしてトリアゾールを形成する反応(Huisgen反応)が、クリック反応(温和な条件下で簡単に安定な結合を形成する反応)の一つとして広く用いられている。特に、この反応は、生体由来の分子とは全く独立して選択的に起こることから、「生体直交的な反応」として、生体関連化学分野で積極的に用いられている。
(注3)PEG脂質:
長鎖のポリエチレングリコール(PEG)の末端に脂質が結合した分子。炭素数が14以上の脂肪酸を有する脂質が結合したものが広く用いられる。生体膜の基本骨格である脂質二分子膜に脂質部分が挿入して、脂質二分子膜にPEG鎖を修飾できる。そのため、ワクチンなどのキャリアに用いられるリポソームの表面をPEG修飾して、血中安定性を上げるのに用いられている。また、基材表面に修飾すると、細胞膜と結合して幅広い細胞を付着できる。
(注4)レクチン:
糖鎖に結合するタンパク質のこと。本研究で用いたrBC2LCNは、共同研究者である産総研の舘野浩章グループ長が、iPS細胞やES細胞の細胞表層糖鎖に存在する特定の糖鎖(Fucα1-2Galβ1-3GalNAc)と選択的に結合するレクチンを発見し、その結合ドメインのみを発現させたものであり、iPS細胞やES細胞の染色などに幅広く利用されている。
(注5)iPS細胞:
人工多能性幹細胞のこと。京都大学の山中伸弥教授の研究グループが開発した細胞であり、理論上、体を構成する全ての細胞に分化誘導することができることから、基礎研究や再生医療分野で応用されている。
(注6)免疫細胞:
白血球の一種で、感染、病気、あるいは望まれない侵入生物を回避する「免疫」を担う細胞。体内で病原性の分子や細胞を分解したり、殺傷したりする。
(注7)MEMS技術:
MEMSは、Micro Electro Mechanical Systemsの略。微小な電気要素と機械要素を一つの基板上に組み込んだデバイスを作製するための技術であり、半導体製造技術やレーザー加工技術など、各種の微細加工技術のことを総称する。
(注8)マイクロ液滴:
オイル等の中に界面活性剤を含む水溶液を吐出することで作られる微小な水滴のこと。マイクロ流路を用いて、オイルの層流の中に水溶液を吐出することで、均一な直径のミクロンサイズの液滴が調製できる。細胞懸濁液を吐出することによって、細胞一つずつを内包した液滴が調製でき、近年、1細胞ずつ操作する技術への応用が盛んに研究されている。
(注9)ナチュラルキラー(NK)細胞:
全身を巡回しながら、がん細胞やウイルス感染細胞などを見つけ次第殺傷する細胞。生まれながらに備わっているからだの防衛機構である自然免疫において、重要な役割を担っている。
(注10)TCR-T細胞:
がん細胞を認識するT細胞受容体(TCR)遺伝子をT細胞に導入して強制発現させ、がん殺傷効果を高めたTCR遺伝子改変T細胞のこと。患者のがん細胞を認識するTCRの選別や品質管理に膨大な時間と労力がかかり、高額な費用が必要となるという課題がある。
(注11)CAR-T細胞:
がん細胞を認識する抗体とリンパ球活性化分子との融合タンパク質(CAR)遺伝子をT細胞に導入して強制発現させ、がん殺傷効果を高めた遺伝子改変T細胞のこと。TCR-T細胞と同様の課題がある。
8.添付資料: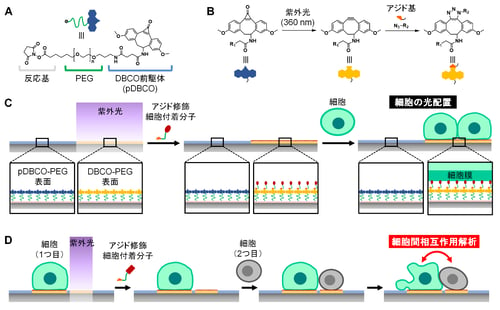 図1(A)光反応性基材修飾材料の構造式。(B)光活性化型DBCO前駆体(pDBCO)の光照射によるDBCOへの変換とアジド基とのHuisgen反応の化学反応式。(C)光反応性表面への細胞付着分子の修飾と細胞の光配置の概念図。(D)細胞の光配置を繰り返すことによって異種細胞のペアを隣接させ、細胞間相互作用を解析する技術の概念図。
図1(A)光反応性基材修飾材料の構造式。(B)光活性化型DBCO前駆体(pDBCO)の光照射によるDBCOへの変換とアジド基とのHuisgen反応の化学反応式。(C)光反応性表面への細胞付着分子の修飾と細胞の光配置の概念図。(D)細胞の光配置を繰り返すことによって異種細胞のペアを隣接させ、細胞間相互作用を解析する技術の概念図。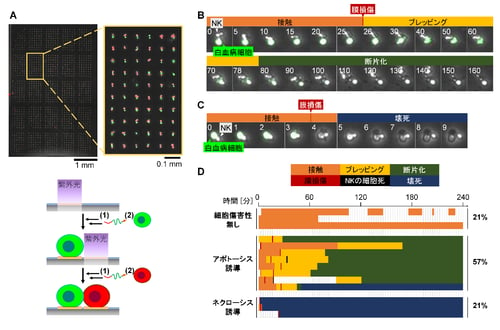 図2(A)赤色と緑色に染め分けた免疫細胞を順次配置して作成した1細胞ペアのアレイの蛍光顕微鏡画像。(B)アポトーシス様の細胞死を誘導した細胞ペアの経時変化画像(数字は経過時間(分))。(C)ネクローシス様の細胞死を誘導した細胞ペアの経時変化画像(数字は経過時間(分))。(D)個々の細胞ペアの細胞傷害性相互作用のチャート。
図2(A)赤色と緑色に染め分けた免疫細胞を順次配置して作成した1細胞ペアのアレイの蛍光顕微鏡画像。(B)アポトーシス様の細胞死を誘導した細胞ペアの経時変化画像(数字は経過時間(分))。(C)ネクローシス様の細胞死を誘導した細胞ペアの経時変化画像(数字は経過時間(分))。(D)個々の細胞ペアの細胞傷害性相互作用のチャート。
プレスリリース本文:PDFファイル
Journal of the American Chemical Society:https://pubs.acs.org/doi/10.1021/jacs.2c07321
おすすめ記事
本件に関連する記事はこちら
どんな細胞も瞬時に望みの位置にくっつける「光活性化細胞付着剤」の開発 ―がん細胞を退治する免疫細胞の識別に応用―
垂直入射型コヒーレント光受信器を開発 ―Beyond 5G用の超高速・超小型光トランシーバ実現に期待―