国立研究開発法人医薬基盤・健康・栄養研究所 (大阪府茨木市、理事長:中村祐輔、以下「NIBIOHN」(ニビオン)という。) 創薬デザイン研究センター(CDDR)を中心とする京都大学、大阪大学、東京大学との共同研究グループは、新たながん治療法の開発につながる、2型腫瘍壊死因子受容体(TNFR2)の機能阻害剤(アンタゴニスト)として、卓越した機能を示すエピトープ*1領域架橋型バイパラトピック抗体(BpAb)の創出に成功しました。
BpAbとは、天然型の抗体では同時にアクセスできない、標的分子の2つの異なる抗体結合部位(エピトープ)に結合するように改変された、人工の二重特異性抗体です。天然の抗体は、目的のアンタゴニスト機能と、受容体活性を促進する機能(アゴニスト機能)が混在し、目的外の作用が副作用となる懸念がありました。
本研究において、NIBIOHNと京都大学大学院薬学研究科(京大院薬)の連携プロジェクトであるCDDR先進バイオ医薬品プロジェクト 研究員 兼 京大院薬 助教(クロスアポイントメント兼務)の秋葉宏樹と、鎌田春彦 同プロジェクトリーダー、永田諭志 CDDR抗体デザインプロジェクトリーダー、及び津本浩平 東京大学大学院工学系研究科教授(研究当時にCDDR招へいセンター長を兼務)らは、藤田純三 大阪大学大学院生命機能研究科 日本電子YOKOGUSHI協働研究所 特任助教(常勤)、難波啓一 同特任教授(常勤)、京大院薬 大野浩章教授らとともに、TNFR2に1:1結合することで、天然型の抗体が引き起こすアゴニスト機能を不活性化し、優れたアンタゴニストとしてのみ機能するBpAbの創出に成功しました。TNFR2は制御性T細胞の活性化を通じてがん免疫の抑制に関わると考えられており、本研究で創製したBpAbは、がんの治療薬として開発されることが期待されます。
本研究の成果は、NIBIOHNの特許技術「エピトープ均質化抗体パネル*2、ならびにその作製方法および利用」を基盤にして得られ、本成果が「エピトープ領域架橋型バイパラトピック抗体、及びそれを製造する方法」として特許に登録されています。本技術は、他の受容体に対しても、優れた機能を有するエピトープ領域架橋型バイパラトピック抗体の創製に広く活用され、高機能抗体医薬品の開発を促進すると期待されます。更にBpAbは人工的に作製される抗体であるため、既存標的に対しても特許性の高い抗体となることが期待されます。
本研究の成果は、2023年9月27日にCommunications Biology誌にオンライン掲載されました。
- 研究の背景と意義
2型TNF受容体(TNFR2)は、制御性T細胞に発現し、リガンドの結合により活性化を受けると細胞を増殖させる働きがあることが示されています。制御性T細胞は、がん組織内で活性化されると、免疫系の働きを抑えてがんの進展を招くと考えられています。そのため、TNFR2の活性化を抑制する物質は、様々ながん種に対する抗がん医薬品として利用できる可能性があります(図1)。そこで、私たちは、TNFR2の活性化を抑えるアンタゴニストを抗体医薬品とするための研究を進めてきました。
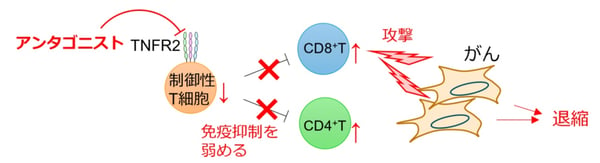
図1. TNFR2アンタゴニストは制御性T細胞による抗がん免疫の抑制状態を解除し、がんの退縮を誘導し得る
TNFR2は、細胞膜上で集合しクラスターを形成することで活性化されます。細胞膜上でTNFR2分子が集積すると、シグナル経路下流の分子もクラスター化し、転写因子NF-κBを活性化し細胞を活性化すると考えられています。通常は、天然の3量体リガンドであるTNFαと結合することでTNFR2も3分子が集まり、これを基点にさらに大きなクラスターが形成されると考えられています。一方で、リガンド結合を競合的に阻害する天然型抗体(アンタゴニスト抗体)も2つの抗原結合領域をもつため、両結合領域が同時にTNFR2に結合することで、微弱ながらこのクラスター形成を有利にし、その活性化を促進してしまいます(図2)。
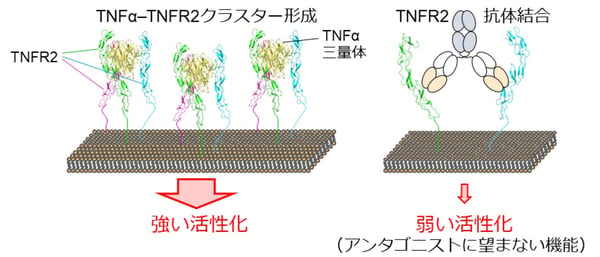
図2. TNFαによるTNFR2活性化<左>と天然型アンタゴニスト抗体では不可避なTNFR2の微弱な活性化(副反応)<右>
そこで私たちが利用したのがバイパラトピック抗体(BpAb)です。BpAbとは、標的とする抗原分子の2つの異なる抗体結合部位(エピトープ)に結合するように人工的に設計した分子です。このため、BpAbとしては、抗原分子同士を架橋する性質のものと、抗体と抗原が1:1で結合するものが得られます(図3)。TNFR2が2分子以上集積することで活性化を促すので、1:1結合するBpAbが取得できれば、活性化を促すことなくアンタゴニストとして機能すると考えられます。しかし、このような1:1の結合様式を明確に示すことで膜蛋白質の機能を制御するBpAbは、これまで報告されていませんでした。
私たちはBpAbの結合するエピトープ領域とBpAbの結合様式の関係を解析し、1:1結合するBpAbの取得に成功しました。本研究の成果は、BpAbアンタゴニストの実用化につながるのみならず、同様の活性化メカニズムを示す受容体に対する抗体医薬品デザインに広くに活用されると期待されます。
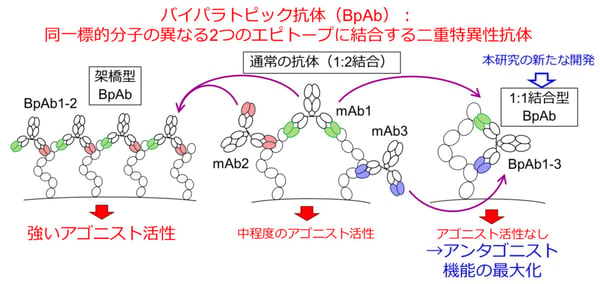
図3. バイパラトピック抗体(BpAb)の抗原結合様式。天然型抗体は抗体:抗原=1:2の複合体を形成するが、BpAbは架橋型複合体または1:1複合体を形成し得る。本研究では、後者の有用性を示した
- 本研究の内容
異なる抗体は、それぞれ固有のエピトープに結合し、異なる機能を示します。CDDRでは、標的抗原分子表面全体に提示されている多様なエピトープに結合し機能する抗体群を網羅的に取得する「エピトープ均質化抗体パネル」法を開発しています(特許7054209)。この中で、TNFR2の複数のエピトープ領域に結合する抗体群を同定していました。本研究では、その中で異なるエピトープグループに属する5点の抗体を選び、以前に私たちの開発し報告した二重特異性抗体作製法(Akiba et al, Sci. Rep. 2021, 11, 19411)を利用して、10点のBpAbを取得しました。5点の天然型抗体と10点のBpAbのアゴニスト活性並びにアンタゴニスト活性をNF-κBレポーター細胞によって調べたところ、天然型抗体はいずれも弱いアゴニスト活性を示し、うち1点(TR109)が同時にアンタゴニスト活性も示しました。一方で、BpAbは10点のうち6点もが、天然型抗体よりも強いアゴニスト活性を示し、2点が強いアンタゴニスト活性を示しました。特筆すべきことに、Bp109-92は、全くアゴニスト活性を示さず、私たちの目標であった、天然の抗体では避けることが難しい、アゴニスト機能の不活性化に成功しました(図4)。
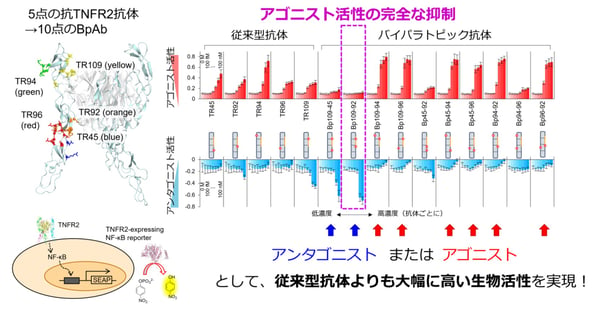
図4. TNFR2に対する10点のバイパラトピック抗体。多くが強いアゴニストである中、Bp109-92はアゴニスト活性を示さない有力なアンタゴニストであった
Bp109-92がアゴニスト活性を全く示さなかった要因として、背景に述べたTNFR2との1:1複合体形成が想定されたため、Bp109-92とTNFR2組換え蛋白質との複合体形成様式を解析しました。複合体のサイズを分析するサイズ排除クロマトグラフィー・多角度光散乱やマスフォトメトリーを利用すると、天然型の抗体は抗体:TNFR2=1:2の複合体を、アゴニストBpAbの多くは2:2以上の大きな複合体を形成する一方で、Bp109-92は予想通り1:1複合体のみを形成しました。この1:1複合体の構造についてクライオ電子顕微鏡による単粒子解析を実施したところ、2つの抗原結合フラグメントが並列してTNFR2に結合することを明らかにしました(図5)。
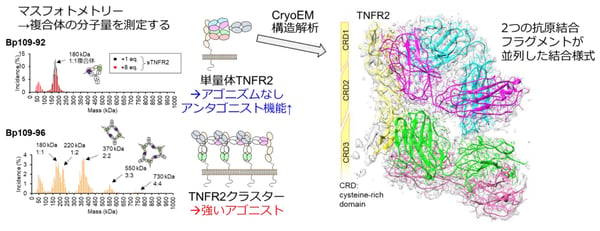
図5. BpAbとTNFR2の形成する複合体の大きさと活性の関連、アンタゴニストBp109-92の複合体構造のクライオ電子顕微鏡による単粒子構造解析
以上の結果から、適切なエピトープに結合する2点の抗体を選定することで、1:1複合体のみを形成するBpAbが取得され、これが優れたアンタゴニストとして機能し得ることを明らかにしました。従来の研究から抗原架橋型BpAbからアゴニストを容易に得られることが知られていましたが、本研究ではこれにとどまらない卓越した機能がBpAbのデザインで実現できることを明らかにしました。
- 波及効果、今後の予定
現在TNFR2抗体は複数の抗体医薬品候補の臨床試験が行われていますが、いずれも天然型抗体であり、本研究成果はそれらを凌駕する医薬品の実用化につながるものであると期待されます。既に成果から出願され成立した特許(特許7101433)「エピトープ領域架橋型バイパラトピック抗体、及びそれを製造する方法」の技術を利用して作製した抗体を企業で評価しているほか、他の標的抗原分子に対するBpAbの開発を進めています。幅広く抗体医薬品の実用化につながる基礎技術となることが期待できます。
- 研究支援
本研究は、日本医療研究開発機構 創薬基盤推進研究事業「バイパラトピック抗体のパネル化による機能的人工抗体の探索デザインの高度化」(代表 秋葉宏樹)を中心に、同機構 BINDS、CiCLE、日本学術振興会 科学研究費補助金、科学技術振興機構 OPERA、京都大学教育研究振興財団、武田科学振興財団、大阪大学 日本電子YOKOGUSHI協働研究所の支援を受けて実施されました。
- 論文情報
論文タイトル:
Development of a 1:1-binding biparatopic anti-TNFR2 antagonist by reducing signaling activity through epitope selection
著者:
Hiroki Akiba, Junso Fujita, Tomoko Ise, Kentaro Nishiyama, Tomoko Miyata, Takayuki Kato, Keiichi Namba, Hiroaki Ohno, Haruhiko Kamada, Satoshi Nagata & Kouhei Tsumoto
掲載雑誌:
Communications Biology volume 6, Article number: 987 (2023)
- 利益相反
秋葉宏樹、永田諭志、津本浩平は、記載されたバイパラトピック抗体に関連する特許の発明者です(PCT/JP2021/013341、JP7101433)。 鎌田晴彦、永田諭志は、NIBIOHN認定ベンチャーであるエピトープサイエンス社の創業者です。
- 関連特許
1.「エピトープ均質化抗体パネル、ならびにその作製方法および利用」
特許権者: 国立研究開発法人医薬基盤・健康・栄養研究所
発明者 : 近藤 裕郷、鎌田 春彦、永田 諭志、水口 賢司、村上 洋一、津本 浩平、秋葉 宏樹
登録番号: JP 特許第7054209号
2.「エピトープ領域架橋型バイパラトピック抗体、及びそれを製造する方法」
特許権者: 国立研究開発法人医薬基盤・健康・栄養研究所
発明者 : 秋葉 宏樹、津本 浩平、永田 諭志
登録番号: JP 特許第7101433号
出願番号: US 17/915,837 , EP 21781490.4 , CN 202180026766.5
- 用語解説
*1 エピトープ:
抗体が結合する標的抗原の部分。一般にエピトープはターゲット分子の小さい一部であり、異なる抗体は、それぞれのエピトープに結合し異なる機能を示す。
*2 エピトープ均質化抗体パネル:
抗体医薬品を開発するに当たっては、対象となる標的分子に結合する無数の抗体の中から医薬として有用な抗体を探り当てる必要がある。「エピトープ均質化抗体パネル」は、標的上のすべてのエピトープグループを網羅した、最小個数の抗体群を表す。これにより抗体機能を最小限の抗体数で探索し抗体医薬に有用な機能を最も強力に発揮する抗体を取りこぼしなく見つけ出すことが可能となる(医薬基盤・健康・栄養研究所 特許技術)。
- 医薬基盤・健康・栄養研究所について
2015 年 4 月 1 日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
ウェブサイト:https://www.nibiohn.go.jp/
プレスリリース本文:PDFファイル
Communications Biology:https://www.nature.com/articles/s42003-023-05326-8
おすすめ記事
本件に関連する記事はこちら
INGOTプロジェクト −革新的な次世代核酸医薬開発の大型プロジェクトがスタート−

一木隆範教授が「医工看共創が先導するレジリエント健康長寿社会」プロジェクトを牽引 ―共創の場形成支援プログラム(令和4年採択)で「看護から社会を変える」―