発表のポイント
◆環境負荷が大きく高価なコバルトを一切含まないにもかかわらず、従来比1.6倍の高いエネルギー密度を有するリチウムイオン電池を実現した。
◆プラス極(正極)、マイナス極(負極)、電解液の同時反応性制御に基づく独自の最適化戦略により、高度な劣化抑制と電圧制限撤廃を達成した。
◆地政学的リスクの高い元素を排除しつつ、高電圧と高容量を担保する現実的な高性能蓄電池の開発が可能になり、持続可能な社会実現への貢献が期待される。

コバルト不使用の超高エネルギー密度リチウムイオン電池の実現
発表概要
東京大学大学院工学系研究科の山田淳夫教授、コ ソンジェ(Ko Seongjae)助教らによる研究グループは、リチウムイオン電池(注1)の開発において見逃されてきた重要な設計因子に着目し、副反応(本来起こってほしくない反応)により引き起こされる劣化について多角的な分析を行った。その結果、これまでの電池設計では、電解液(注2)が起こす副反応と電極が起こす副反応のいずれかが十分に抑制されていないことを明らかにした。そこで、これら2つの副反応を同時に抑制する電解液設計を施すことで電圧制限を撤廃し、コバルトを使用しない高エネルギー密度のLiNi0.5Mn1.5O4|SiOx電池(注3)の実用レベルでの安定作動(初期容量比80%維持率/1000回充放電)に初めて成功した。これにより、高価な貴金属であるコバルトを含まないにもかかわらず、従来比1.6倍の高いエネルギー密度と長い寿命をあわせ持つ革新的な二次電池実現の可能性が示された(図1)。
本研究成果は、10月19日付の英国の学術雑誌Nature Sustainability電子版に掲載された。

図1:持続可能性を備えた高エネルギー密度リチウムイオン電池の実現
コバルトを使用せず高電圧を発生するLiNi0.5Mn1.5O4正極と、豊富な資源を主成分とする高容量のSiOx負極から構成される理想的なリチウムイオン電池の実現は、持続可能社会への移行に大きく貢献する。
発表内容
〈研究の背景〉
コバルトは、リチウムイオン電池のプラス極(正極)の安定性と機能性を向上させる不可欠な元素として、1991年の商品化当初から現在まで継続的に使用されてきた。しかし、コバルトは高価な希少金属であるばかりでなく、環境汚染の危険性も高い。さらに、生産の70%以上を政情不安定なコンゴ民主共和国が担っていることから、市場価格の激しい騰落を引き起こしてきた。加えて、産地における児童労働等の人権侵害も深刻な懸念事項である。一方で、コバルトを使用せず、安価で高い安全性と耐久性を実現するリン酸鉄リチウム(LiFePO4,LFP)を正極に採用したリチウムイオン電池がここ数年で爆発的に普及しており、数年以内に市場シェア50%を超え将来的には主流技術になることが、世界の主要企業の量産投資状況から確実視されている。しかし、リン酸鉄リチウムを採用すると、エネルギー密度が20%程度低下してしまう。このような背景から、コバルトを使用せず低価格でありながら高エネルギー密度を担保する理想的な蓄電システムとして、高電圧を発生するLiNi0.5Mn1.5O4 正極と高容量のSiOx負極から構成される電池が提案されたものの、高電圧作動時の劣化を抑制することができず、その安定作動は長らく実現されてこなかった。
〈研究の内容〉
本研究グループは、電池の中で起こる副反応(本来起こってほしくない反応)に対する新たな知見をベースに新規電解液を設計することで電圧制限を撤廃し、コバルトを使用しないリチウムイオン電池としては従来比1.6倍のエネルギー密度を有するLiNi0.5Mn1.5O4|SiOx電池の安定作動を実現した。
電池の作動安定性を向上するには、エネルギーを蓄積したり取り出したりするための反応のみを起こし、それ以外の反応(副反応)をできるだけ抑制する必要がある。この副反応には、(i)電解液が起こす副反応と(ii)電極が起こす副反応の2種類があり、双方を高度に抑制する必要がある。これまでは要因(i)に主眼を置いた電解液の開発が行われてきたが、高エネルギー密度電池における十分な安定動作は達成されてこなかった。最近、山田教授の研究グループにより電極電位(注4)と連動する要因(ii)の存在が初めて顕在化され、そのメカニズムも解明された(注5)。本研究では、この新たな知見をベースに、上記2つの副反応活性を同時に抑制し、電圧制限撤廃を可能にする新規電解液をゼロベースで設計した(図2)。
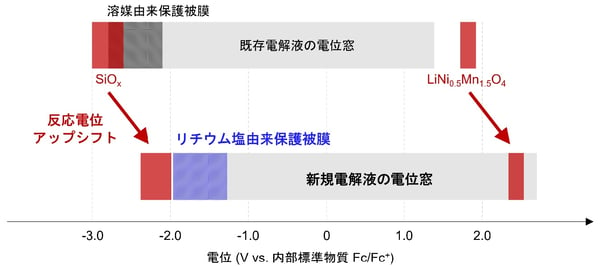
図2:新規電解液設計指針による高酸化・高還元安定性の同時実現
従来の電解液においては、LiNi0.5Mn1.5O4正極とSiOx負極の電極電位(赤色部分、注4)が電解液の安定電位窓(灰色部分)の外に存在したため、激しい電解液分解を引き起こした。また、SiOx負極は充放電に伴いその体積が200%以上膨張/収縮し、電極表面保護被膜の剥離や負極の亀裂による大きな劣化要因となる。これらのことから、LiNi0.5Mn1.5O4|SiOx電池の安定作動は今まで実現できなかった。一方、本研究で新たな設計指針のもと開発した電解液中では、正極と負極の反応電位が電解液の電位窓上限を超えない範囲まで最大限に高電位シフトしており、負極における電解液還元分解の駆動力が大きく低下した。さらに負極表面に、従来の電解液溶媒由来の保護被膜より強固なリチウム塩由来保護被膜を形成することで、SiOxの大きな体積変化に起因するさまざまな問題を克服することができた。
具体的な電解液の設計指針として、①プラス極(正極)側で副反応が起きない溶媒の採用、②マイナス極(負極)側で副反応を防止する保護被膜形成ができるリチウム塩の選択、③マイナス極(負極)の副反応を抑制しつつ、プラス極(正極)側でも副反応を起こさないためのリチウム塩の濃度制御、を総合的に考慮して最適化した。これら複数の施策の有効性に加え、SiOx負極表面への膨張収縮耐性付与、正極からの遷移金属溶出防止、アルミニウム正極集電体の腐食防止等の効果があわせて確認され、LiNi0.5Mn1.5O4|SiOx電池など高電圧電池特有の諸問題が一挙に解決された。これにより、高価な希少金属であるコバルトを含まないにもかかわらず、高エネルギー密度を担保するLiNi0.5Mn1.5O4|SiOx電池の実用レベルの安定作動(初期容量比80%維持率/1000回充放電)に初めて成功した(図3)。
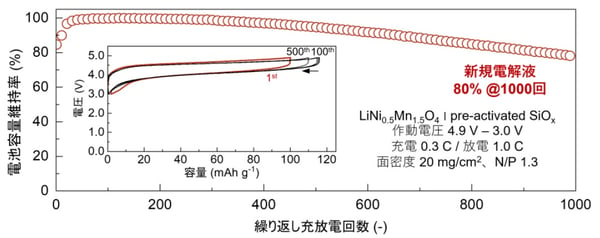
図3:LiNi0.5Mn1.5O4正極とSiOx負極からなる高エネルギー密度リチウムイオン電池の充放電サイクル特性
電解液の劣化分解が高度に抑制されるとともに、正極活物質からの遷移金属溶出や正極アルミニウム集電体の腐食といった高電圧電池特有のさまざまな問題が一挙に解決され、1000回以上の安定な繰り返し充放電が達成された。
〈今後の展望〉
低炭素・持続可能社会の構築に向け、電池製造原料における資源戦略や企業の社会的責務を包括的に考慮した電池システムの開発が必要である。本研究で見出した新たな高エネルギー密度電池の設計指針は、高価な希少金属であるコバルトを使用していないにもかかわらず、従来の1.6倍のエネルギー密度を有するLiNi0.5Mn1.5O4|SiOx電池の安定作動が可能であることを示した。ここで達成されたリチウムイオン電池の根本的な作動電圧限界の撤廃は、今後の蓄電池開発の現実的な方向性を拓くものである。既存の製造ラインもそのまま活用できることから、環境・資源問題を考慮した高性能電池システムが実現するとともに、電気自動車用二次電池や再生可能エネルギーの出力平滑化用二次電池など、現行型を含むさまざまな電池のエネルギー密度と信頼性の向上に寄与すると期待される。これにより、広範な分野での蓄電池導入が促進され、低炭素・持続可能な社会への移行に大きく貢献すると考えられる。
〈関連のプレスリリース〉
「プレスリリース名:蓄電池の高エネルギー密度化へ新たな方向性」(2022/10/28)
http://www.yamada-lab.t.u-tokyo.ac.jp/pr/202210
発表者
東京大学大学院工学系研究科化学システム工学専攻
山田 淳夫(教授)
コ ソンジェ(Ko Seongjae)(助教)
論文情報
〈雑誌〉Nature Sustainability
〈題名〉Electrolyte design for lithium-ion batteries with a cobalt-free cathode and silicon oxide anode
〈著者〉Seongjae Ko, Xiao Han, Tatau Shimada, Norio Takenaka, Yuki Yamada, Atsuo Yamada*
〈DOI〉10.1038/s41893-023-01237-y
〈URL〉https://www.nature.com/articles/s41893-023-01237-y
研究助成
本研究は主に、文部科学省データ創出・活用型マテリアル研究開発プロジェクト「再生可能エネルギー最大導入に向けた電気化学材料研究拠点」(DX-GEM、課題番号:JPMXP1122712807)、国立研究開発法人科学技術振興機(JST)共創の場形成支援プログラム(COI-NEXT、課題番号:JPMJPF1234)、科学研究費助成事業基盤研究S(課題番号:20H05673)の支援により実施されました。
用語解説
(注1)リチウムイオン電池
繰り返し充電して使用することができる蓄電池の一種。リチウムイオンが正極→電解液→負極と移動することで充電が行われ、逆に負極→電解液→正極と移動することで放電が行われる。他の蓄電池と比較して高電圧(現在2.4-3.8 V程度)かつ高エネルギー密度であるため、携帯電話・ノートパソコンや電気自動車の電源として広く普及している。
(注2)電解液
蓄電池の正極と負極の間において特定のイオンの移動を媒介する液体材料。例えば、リチウムイオン電池の電解液は、溶媒分子、リチウムイオン、アニオン分子から構成される液体であり、有機溶媒にリチウム塩を溶解したものが用いられる。
(注3)LiNi0.5Mn1.5O4|SiOx電池
コバルトを使用せず高い電極電位(注4)を発生するLiNi0.5Mn1.5O4正極(理論容量147mA/g、作動電位≥4.7V対リチウム)と豊富な資源を主成分とする高容量のSiOx負極(理論容量<4200 mA/g、作動電位≤0.4V対リチウム)から構成される電池。理想的な電池構成として長年研究されたが、正極と負極の反応電位が電解液の電位窓の外に存在するため、激しい電解液の劣化分解を引き起こす。また、シリコン系負極は充放電に伴いその体積が200%以上膨張/収縮し、電極表面保護被膜の剥離や負極の亀裂による大きな劣化要因となる。これらの理由からLiNi0.5Mn1.5O4|SiOx電池の安定作動は今まで実現できなかった。
(注4)電極電位
リチウムイオン電池の正極と負極を構成する活物質がリチウムイオンと反応する際の電子の授受のしやすさを規定する指標値。この値が大きいほど電子を受けとりやすく、プラス極(正極)に適している。例えば、正極活物質のLiNi0.5Mn1.5O4とLiFePO4はそれぞれ≥4.7Vと≥3.4V対リチウムの反応電位を有する。負極活物質のSiOxと黒鉛はそれぞれ≤0.4Vと≤0.1V対リチウムの反応電位を示す。これら正極と負極の電位差を電池の電圧と定義する。従って、高電位正極と低電位負極を組み合わせることで高電圧のリチウムイオン電池を設計できるが、その安定作動を実現するためには正極と負極の表面における電解液の分解を高度に抑制する必要がある。
(注5)電極電位シフトとその支配因子
山田淳夫教授らの研究グループは最近の研究で、電極電位が電解液によって大きく変化する現象とその本質的原因を、機械学習による要因解析と新概念“液相マーデルンポテンシャル”の提唱により明らかにしている(詳細は電気化学会誌2023年Volume91.No2,p140の解説記事を参照)。本研究では、この基本原理に基づいた電解液設計により、副反応を劇的に抑制することに成功した。
※10/20 電気化学会誌の発行年を修正
プレスリリース本文:PDFファイル
Nature Sustainability:https://www.nature.com/articles/s41893-023-01237-y
おすすめ記事
本件に関連する記事はこちら
計算化学に基づいて巧みに分子設計された 超高活性アンモニア生成触媒の開発に成功! ―触媒活性の世界最高記録を大幅に更新!―
スキルミオンによるトポロジカル磁気光学効果の観測に成功 ―スキルミオンメモリの高速光読み取りに道筋―