発表のポイント
◆環状ペプチドのアミド結合をエステル結合に置換することで、環状ペプチドの受動的膜透過性が大幅に向上することを見出しました。
◆最新鋭の分子シミュレーションと核磁気共鳴(NMR)装置による構造解析により、アミド-エステル置換による環状ペプチド膜透過性向上のメカニズムを明らかにしました。
◆これまで標的とすることが困難だった細胞内タンパク質に作用する環状ペプチドの設計技術が進歩し、ペプチド創薬が加速することが期待されます。
本研究の概要
発表概要
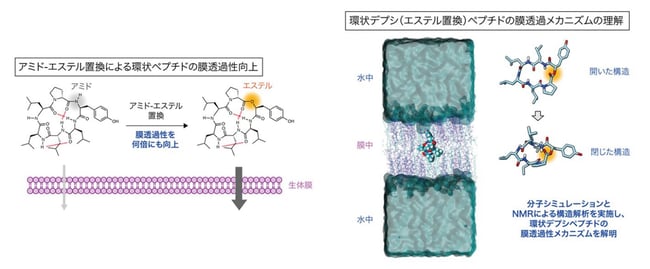
東京大学大学院工学系研究科の山東信介教授、森本淳平講師、細野裕基大学院生(研究当時)、内田聡大学院生、新開萌大学院生、植木亮介助教(研究当時)のグループは、東京大学大学院薬学系研究科の竹内恒教授、上田卓見准教授らのグループ、同研究科の金光佳世子特任講師らのグループ、東京工業大学情報理工学院の秋山泰教授、杉田昌岳特任助教(研究当時)らの研究グループ、University of California, Santa CruzのScott Lokey教授らの研究グループと共同で、環状ペプチドのアミド結合(注1)をエステル結合(注2)に置換することによって受動的膜透過性(注3)が飛躍的に向上することを明らかにしました(図1左)。
近年、ペプチドを用いた創薬研究が活発に行われており、特に環状構造を有するペプチド(環状ペプチド)が、高いタンパク質阻害活性や生体安定性を示すことから注目され、薬剤候補として期待されています。環状ペプチドはアミノ酸がアミド結合により連結した構造からなりますが、天然に存在する膜透過性の高い環状ペプチドは、アミド結合の代わりにエステル結合を含んでいるものが多数存在します。本研究では、環状ペプチドの特定のアミド結合をエステル結合に置換(アミド-エステル置換)することによって、受動的膜透過性が大きく向上することが示されました。また、環状ペプチドが膜を透過するプロセスを分子シミュレーションと実験化学の両面から研究し、アミド-エステル置換によって環状ペプチドの受動的膜透過性が向上するメカニズムを明らかにしました(図1右)。
本研究の成果により、細胞膜を受動的に透過する環状ペプチドの創出が加速し、がんや神経変性疾患などこれまで治療が困難だった疾患に対するペプチド創薬が発展すると期待されます。

図1:本研究の概要
(左)アミド-エステル置換によって環状ペプチドの受動的膜透過性が向上することの概念図。(右)分子シミュレーションとNMRデータに基づく環状デプシペプチドの膜透過プロセス。水中と膜中でみられた環状ペプチドの代表的な3次元構造を右に示している。
(Nat.Commun. DOI: 10.1038/s41467-023-36978-z, (2023)より一部改変して転載。)
発表内容
〈研究の背景〉
近年、環状ペプチドをモダリティ(注4)とした創薬研究が活発化していますが、多くのペプチドの受動的膜透過性が低いことが大きな障壁となり、細胞内タンパク質に対するペプチド創薬の実現が阻まれています。自然界には、受動的に細胞膜を透過し、細胞内のタンパク質に作用する環状ペプチドが存在しますが、その中には、主鎖のアミド結合の一部がエステル結合に置き換わったデプシペプチド(注5)と呼ばれるペプチドが多数存在することが知られています。そのため、環状ペプチド主鎖へのエステル結合の導入は、高い受動的膜透過性を示す環状ペプチドを実現する上で有用であると推定されます。しかしながら、これまで、環状ペプチドのアミドをエステルに置換することによって、環状ペプチドの受動的膜透過性がどのように影響を受けるかを直接調べた研究は存在しませんでした。
〈研究の内容〉
本研究では、環状ペプチドにアミド-エステル置換を施すことで、ペプチドの受動的膜透過性がどのように影響を受けるかを初めて定量的に評価しました。その結果、膜内のような脂溶性環境中でアミド水素が表面に露出している部分を狙ってアミド-エステル置換を施すことで、環状ペプチドの膜透過性が飛躍的に向上することを初めて示しました。アミド-エステル置換は、6〜9残基のさまざまな環サイズの環状ペプチドの膜透過性を向上させられることから、汎用性の高い膜透過性向上手法として期待できます。
また、現在広く用いられている受動的膜透過性向上手法であるアミドNメチル化との比較も実施し、アミド-エステル置換の方がアミドNメチル化よりもさらに大きく環状ペプチドの膜透過性を向上する場合があることも示されました。なぜアミド-エステル置換によって環状ペプチドの膜透過性が向上したのか、その理由を理解することは、今後、膜透過性の高い環状ペプチドの合理設計技術を発展させていく上で重要です。
本研究では、東京工業大学のチームが開発した最新鋭の分子シミュレーションの手法と、NMRによる構造解析技術を組み合わせることで、環状ペプチドの膜透過性のメカニズムとアミド-エステル置換による膜透過性向上の理由を詳細に研究しました。その結果、まず、環状ペプチドが水中から膜中へと移行する際に開いた構造から閉じた構造へと変化していく様子が明らかとなりました。また、アミド-エステル置換を施した環状ペプチドも同様のダイナミックな構造変化をしながら膜を透過することがわかりました。このようなダイナミックな膜透過プロセスにおいて、アミド-エステル置換を施した環状ペプチドは、表面に露出したアミド水素の数が元の環状ペプチドよりも減少しているために、水中から脂質膜内へと侵入する際のエネルギー障壁の低下や脂質膜内での安定性の向上が起こり、その結果として、膜透過性が大きく向上していることが示唆されました。
また、本研究では、環状デプシペプチドの生体内安定性についても評価がなされています。従来、エステル結合を含むデプシペプチドは、化学的安定性が低いために生体応用に適さないと考えられることがありました。しかしながら、本研究で、血清中などでの安定性を評価したところ、迅速な分解は見られず、環状デプシペプチドが生体応用に十分な安定性を示すことが明らかになりました。
〈今後の展望〉
本研究の成果は、環状ペプチドをモダリティとする創薬研究に大きな波及効果を及ぼすと考えられます。これまで、環状ペプチドは、細胞内のタンパク質を標的とした薬剤候補分子として注目されてきましたが、多くの環状ペプチドの膜透過性が低いことが課題となっていました。本研究で明らかになったように、アミド-エステル置換を利用することで、高い膜透過性を示す環状ペプチドの開発が加速すると期待されます。また、分子シミュレーションとNMR構造解析によって明らかとなった環状ペプチドの膜透過メカニズムを考慮に入れ、従来用いられてきたアミドNメチル化の手法にアミド-エステル置換の手法を適切に組み合わせることで、膜透過性の高い環状ペプチドの創出手法がさらに進歩していくと考えられます。これにより、がんや神経変性疾患などこれまで治療が困難だった疾患への治療薬が実現するなど、人類の健康増進に関わる大きな社会的意義が見込まれます。
研究グループの構成員
東京大学
大学院工学系研究科
山東 信介(教授)
森本 淳平(講師)
細野 裕基(博士課程:研究当時)
内田 聡(修士課程)
新開 萌(修士課程)
植木 亮介(助教:研究当時)
大学院薬学系研究科
竹内 恒(教授)
上田 卓見(准教授)
金光 佳世子(特任講師)
石井 真由美(学術専門職員)
東京工業大学情報理工学院
秋山 泰(教授)
杉田 昌岳(特任助教:研究当時)
Department of Chemistry and Biochemistry, University of California, Santa Cruz
Scott Lokey(教授)
Chad E. Townsend(博士課程:研究当時)
Colin N. Kelly(博士課程:研究当時)
Matthew R. Naylor(博士研究員:研究当時)
Hsiau-Wei Lee(Director of NMR Technology)
論文情報
〈雑誌〉 Nature Communications
〈題名〉 Amide-to-ester substitution as a stable alternative to N-methylation for increasing membrane permeability in cyclic peptides
〈著者〉 Yuki Hosono, Satoshi Uchida, Moe Shinkai, Chad E. Townsend, Colin N. Kelly, Matthew R. Naylor, Hsiau-Wei Lee, Kayoko Kanamitsu, Mayumi Ishii, Ryosuke Ueki, Takumi Ueda, Koh Takeuchi, Masatake Sugita, Yutaka Akiyama*, Scott R. Lokey*, Jumpei Morimoto*, Shinsuke Sando*
〈DOI〉 10.1038/s41467-023-36978-z
〈URL〉 https://www.nature.com/articles/s41467-023-36978-z
研究助成
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「データ駆動型サイエンスによる中分子細胞膜透過性の創造」(課題番号:JPMJCR21N5)、科学技術振興機構(JST)戦略的創造研究推進事業(さきがけ)「サブナノ有機ブロックの配列による有機構造体の緻密設計」(課題番号:JPMJPR21AF)、文部科学省地域イノベーション・エコシステム形成プログラム「IT創薬技術と化学合成技術の融合による革新的な中分子創薬フローの事業化」、科研費「薬物とGPCRの弱い相互作用が滞在時間に応じて生体応答を制御する機構の解明(課題番号:JP21H05509)」、科研費「中分子の膜透過を評価し膜透過活性を付与する創薬基盤技術の構築(課題番号:JP20K21494)」、科研費「NMR法を用いた細胞内創薬技術の開発(課題番号:JP22K18374)」、科研費「中分子創薬に適した特性を有する環状ペプチド分子設計手法の開発(課題番号:JP17H01814)」、アメリカ国立衛生研究所グラント「Cyclic peptide permeability (課題番号:GM131135)」、国立研究開発法人日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:JP22ama121053)の支援により実施されました。
用語解説
(注1)アミド結合
カルボン酸とアミンから脱水縮合反応によって生成する結合のこと。R1-C(=O)-NHR'などの一般式であらわされる。
(注2)エステル結合
カルボン酸とアルコールから脱水縮合反応によって生成する結合のこと。R1-C(=O)-OR'の一般式であらわされる。
(注3)受動的膜透過性
化合物がエネルギーなどを必要とせず細胞の膜を受動的に透過する性質。受動的膜透過性が高いと、経口投与可能な薬剤および細胞内タンパク質を標的とした薬剤が実現できる可能性が向上する。
(注4)モダリティ
医薬品を構成する分子の構造やサイズなど分子の種別のこと。
(注5)デプシペプチド
エステル結合を含むペプチドの総称。
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-023-36978-z
おすすめ記事
本件に関連する記事はこちら
環状ペプチドのヒト血清アルブミンに対する結合様式を解明~環状ペプチド創薬の加速に期待~:化学生命工学専攻 妹尾暁暢(博士課程)、バイオエンジニアリング専攻 津本浩平 教授、長門石曉 特任准教授ら