2021.07.28
ラマン・蛍光による超多重イメージングを高速化〜複雑で多様な細胞の詳細な解析が可能に〜
1.発表者:
小関泰之(東京大学 大学院工学系研究科電気系工学専攻 教授)
寿 景文(東京大学 大学院工学系研究科電気系工学専攻 博士課程3年)
オダロバート(慶應義塾大学 医学部薬理学教室 特任助教)
塗谷睦生(慶應義塾大学 医学部薬理学教室 准教授)
安井正人(慶應義塾大学 医学部薬理学教室 教授)
2.発表のポイント:
◆分子振動由来の誘導ラマン散乱(SRS)(注1)と、蛍光分子(注2)の発光を検出する統合イメージングシステムを開発しました。本システムでは、SRS信号と蛍光を同時検出するとともに、分子振動周波数・蛍光励起波長・蛍光検出波長を高速に切り替えることが可能です。これにより、超多重イメージング(注3)を高速に行うことができます。
◆本システムを用い、ラマン標識(注4)と蛍光標識(注5)を施された生細胞の8多重イメージングを従来報告より20倍以上高速な30秒以内で行うことが可能になりました。また、この手法を用いて、生きた細胞内の小器官の複雑な相互作用や、多数の細胞の小器官の分布を詳細に調べることに成功しました。
◆本技術は、複雑で多様な細胞の詳細な解析を実現するものであり、生命の仕組みの解明や、薬剤開発への応用展開が期待されます。
3.発表概要:
東京大学大学院工学系研究科電気系工学専攻の小関泰之 教授、寿景文 博士学生、慶應義塾大学医学部薬理学教室のオダロバート 特任助教、塗谷睦生 准教授、安井正人 教授らは、コロンビア大学、清華大学、ハワイ大学との共同研究グループとともに、細胞内生体分子を誘導ラマン散乱(SRS)により検出するSRS顕微法と、蛍光分子の発光を検出する蛍光顕微法を統合し、複雑で多様な細胞を詳細に解析する技術を開発しました。
開発したSRS・蛍光統合イメージングシステムでは、分子振動周波数・蛍光励起波長・蛍光検出波長を高速に切り替えることができ、1秒間に30フレームのラマン画像・蛍光画像を取得しつつ、フレームごとに分子振動周波数・蛍光励起波長・蛍光検出波長を設定することができます。これにより、生体試料の超多重イメージングに要する時間を大幅に削減しました。
本システムを用い、ラマン標識と蛍光標識された生細胞内の8多重イメージングを30秒以内で行うことが可能になりました。これは、従来のSRS・蛍光顕微鏡と比較して20倍以上高速です。また、この手法を用いて、生きた細胞内の小器官が複雑に動き回って相互作用する様子や、多数の細胞内における小器官の空間分布を詳細に調べることに成功しました。
本技術を用いることによって、複雑で多様な細胞内の仕組みをより詳細に解析することができ、生命の仕組みの解明への貢献や、薬剤開発への応用展開が期待されます。
本研究成果は、Elsevier社の科学誌「iScience」のオンライン版(2021年7月27日付け)で公開されました。
4.発表内容:
(1)研究の背景・先行研究における問題点
生物は多様な細胞から構成され、また、細胞の中でも様々な細胞小器官が動き回りながら複雑に相互作用することで生命活動を維持していると考えられています。このように複雑で動的な生物の仕組みを調べるためには、生きた細胞内の複数の生体分子を高い時間・空間分解能で同時に視覚化することが重要です。近年では、細胞内の多種の生体分子を可視化する技術として、サイクリック免疫染色(注6)や質量イメージング(注7)などの技術も登場していますが、これらの手法で生きたままの生体試料を観察することはいまだ困難です。蛍光イメージング法は観察対象に蛍光分子を付与(蛍光標識)して可視化する手法であり、生きたままの生体試料の観察も可能です。しかし、蛍光イメージングでは同時観察が可能な分子種が5-6種に限られています。この「色数の壁」は、蛍光のスペクトル幅が広い(50 nm程度)ことに由来するものです。また、ブドウ糖、アミノ酸、核酸など、生体を構成する小さな生体分子は蛍光標識が未だ困難です。これは、これらの小さな生体分子に蛍光標識を行うとその生物学的な性質が変化してしまうためです。
近年、分子振動を光学的に検出するラマンイメージング法が注目を集めています。ラマンイメージングを用いることで無標識での生体分子の可視化や、アルキン・同位体・ラマンプローブなどのラマン標識を用いた小さな生体分子の可視化、分子振動スペクトルの狭帯域性を活かした超多重イメージングなどが実現されています。このようにラマンイメージングは蛍光イメージングにない特徴を持っており、近年ではラマンイメージングと蛍光イメージングを同時に行うことで、複数の生体分子を同時に可視化できることが示されています。様々なラマンイメージング法の中でも、誘導ラマン散乱(SRS)イメージングは、蛍光の漏れ込みの影響がほとんどないという特長を有することから、ラマン・蛍光の同時イメージングに有利です。
しかし、従来のSRS・蛍光イメージングでは、時間分解能が低いという課題がありました。その理由は、SRSと蛍光の切り替え時間、複数の分子振動周波数の信号を取得するためのレーザー波長の切り替え時間、複数の波長の蛍光を検出するための光フィルターの切り替え時間などによるものです。このため、SRS・蛍光イメージングによる超多色イメージングでは1枚の画像を得るために10分以上を要し、細胞内の相互作用を時系列で解析することや、多数の細胞を計測することは困難でした。
(2)研究内容
本研究では、細胞内の複雑な相互作用や、細胞の多様性を明らかにすることを目的とし、SRS・蛍光統合イメージングシステムを開発しました。これにより、超多重イメージングを、従来報告よりも20倍以上高速化することに成功しました。また、本手法を用いて、時々刻々と変化する生きた細胞内の超多重イメージングおよび多数の細胞の超多重イメージングを行い、複数種の小器官の経時的な動きや細胞ごとの小器官の空間分布の多様性を計測することに成功しました。本手法は、複雑で不均一な細胞内の様々な相互作用を調べるための強力なツールになります。
本研究で構築したSRS・蛍光統合イメージングシステムの概略図を図1Aに示します。本システムでは、SRS画像と蛍光画像を同時に毎秒30フレームずつ取得しつつ、フレームごとにSRSで検出する分子振動周波数、蛍光励起波長、蛍光検出波長を制御します。具体的には、SRSイメージングのための2色の近赤外ピコ秒パルス(ポンプ光、ストークス光)と、蛍光イメージングのための4色の励起光を合波して顕微鏡に導入します。試料透過光のうちポンプ光をロックイン検出することでSRS信号を得ます。同時に、試料から発せられた蛍光を共焦点ピンホールおよび波長フィルターを介して光検出器で検出します。ストークス光の波長および蛍光フィルターの透過波長はガルバノスキャナ(GS1, GS2)の角度を変えることで高速に制御します。また、蛍光励起光をON/OFFすることで励起波長を制御します。このような機構を用いて、SRSと蛍光の切り替えや、レーザー波長切り替えの時間を低減し、SRS・蛍光イメージングの高速化を実現しました。
このSRS・蛍光統合イメージングシステムを用いると、SRS 4色・蛍光4色の計8色のイメージングをわずか0.14秒で行うことが可能です(図1B)。ここでは蛍光標識された4種類のポリマービーズ(PA, PEMA, PMMA, PS)と、4種の蛍光分子で標識されたPSビーズを観察しました。SRSで検出する分子振動周波数、蛍光励起波長(Ex)、蛍光検出波長(De)に応じてコントラストの異なる画像が得られたことが見て取れます。また、線形分離処理によって各成分の画像を得てカラー表示を行うこともできました(図1C)。
本システムを用いて、生体試料の超多重イメージングを行いました。まず、ラマンプローブを用いて生細胞のミトコンドリア(Mito)、リソソーム(Lyso)、脂肪滴(LD)、小胞体(ER)を染色し、また、蛍光プローブを用いて細胞核(Nucleus)、細胞膜(PM)、チューブリン(Tublin)、アクチン(Actin)を染色し、8多重画像を30秒で取得しました(図2A)。また、生体分子の無標識・2色SRSおよび6色蛍光イメージングにより、8多重イメージングを2秒以内に行うことや(図2B)、マウス脳組織の3色SRS・4色蛍光イメージングにより7多重イメージングを16秒で行うこと(図2C)に成功しました。また、同位体標識された飽和脂肪酸(PA-d31)および不飽和脂肪酸(AA-d8)分子を細胞に投与し、SRSイメージングおよび5色蛍光イメージングを行うことで、2種類の脂肪酸が細胞に取り込まれ、代謝される際の細胞内の小器官の様子を調べることができました(図2D)。AA-d8を除去したのちのAAとPAの比を調べたところ、細胞ごとに大きな不均一性があることが見て取れます。
このSRS・蛍光統合イメージングシステムを用いることで、細胞内における小器官の動きの詳細な観察や、細胞ごとの小器官の局在の違いを調べることにも成功しました。これらは、従来のSRS・蛍光イメージングシステムでは実現できなかったことであり、SRS・蛍光統合イメージングシステムによって、超多重イメージングの適用可能性が大きく広がったことを示しています。
(3)今後の展開
今回開発したSRS・蛍光統合イメージングシステムは、超多重イメージングの時間分解能を高め、複雑で多様な細胞の詳細な解析を実現するものです。本イメージングシステムで得られる詳細な画像データは、仮説主導の研究だけでなく、発見主導の研究にも役立つと期待されます。本技術は、細胞小器官の相互作用や輸送など、細胞内の様々な生命活動が、栄養環境、薬物、病原体などによってどのように影響を受けるかを調べる強力な手法となり、生命の仕組みの解明や、創薬の研究を加速すると期待されます。
なお、本システムによる生体観察の速度は信号対雑音比によって制限されています。今後、より信号強度の高いラマンプローブの開発や、量子光学によるSRSの雑音低減等を行うことで、更なる高速な観察も可能となると期待され、それによって本システムの適用可能性がさらに広がることが期待されます。
(4)特記事項
本研究は科学技術振興機構CREST「量子光源による超高感度分子イメージング」(JPMJCR1872)、科学研究費補助金(JP19J22546, JP20H02650, JP20H05725, JP18K18847)、文部科学省Q-LEAP(JPMXS0118067246)、NIH (R01 GM128214)の支援を受けて行われました。
5.発表雑誌:
雑誌名:「iScience」(オンライン版:7月27日)
論文タイトル:Super-multiplex imaging of cellular dynamics and heterogeneity by integrated stimulated Raman and fluorescence microscopy
著者: Jingwen Shou, Robert Oda, Fanghao Hu, Keiko Karasawa, Mutsuo Nuriya, Masato Yasui, Bruce Shiramizu, Wei Min and Yasuyuki Ozeki*
DOI番号:https://doi.org/10.1016/j.isci.2021.102832
アブストラクトURL: https://www.cell.com/iscience/fulltext/S2589-0042(21)008002
6.用語解説:
注1 誘導ラマン散乱(SRS)
光周波数が異なる2つの光と分子の相互作用のひとつ。2つの光のうち高周波側の光はポンプ光、低周波側の光はストークス光と呼ばれる。ポンプ光とストークス光の光周波数の差が、分子構造で決まる分子振動共鳴周波数と一致するとき、ポンプ光が減衰し、ストークス光が増幅される。これらの効果をSRSと呼ぶ。近年、顕微鏡下でSRSを検出することで試料の分子振動情報をもとに画像化を行うSRS顕微法の研究が盛んに進められている。
注2 蛍光分子
蛍光とは、分子が光を吸収して基底状態から励起状態に遷移し、その後、励起状態から基底状態に戻る際に励起光より長波長の光を発生することをいう。また、蛍光を発生する分子を蛍光分子という。
注3 超多重イメージング
複数の観察対象を同時に観察することを多重イメージングという。蛍光イメージングでは蛍光スペクトルの幅が広いことから、スペクトルの重なりを抑えつつ可視光帯で多重検出するには6多重程度が現実的な上限であると考えられ、「色数の壁(color barrier)」と呼ばれる。これに対して、分子振動はスペクトル幅が狭いことから、20種類程度の分子振動周波数を有する分子をラマン散乱によって識別することも可能であることがわかってきた。ラマン散乱を用いる、もしくはラマン散乱と蛍光を併用することによって、蛍光の色数の壁を超える多重度をもってイメージングを行うことを超多重イメージングという。
注4 ラマン標識
生体のある部位を特異的に観察するために、特徴的な分子振動を有する分子(ラマンプローブ)を、観察対象に付与することをラマン標識という。ラマン標識した分子はラマンイメージングによって観察できる。
注5 蛍光標識
生体のある部位を特異的に観察するために蛍光分子を付与することを蛍光標識という。
注6 サイクリック免疫染色
抗体を用いて生体試料の特定の分子に蛍光標識を行い、試料の蛍光イメージングを行った後、化学処理によって蛍光分子を光らなくさせるプロセスを繰り返すことで、複数種の生体分子を可視化する手法。
注7 質量イメージング
生体試料にレーザー光を照射し、生体分子をイオン化してその質量を計測することで生体分子を識別して検出する手法を質量分析法という。また、試料位置を走査しながら質量分析を行うことで生体分子の空間分布を計測することを質量イメージングという。
7.添付資料: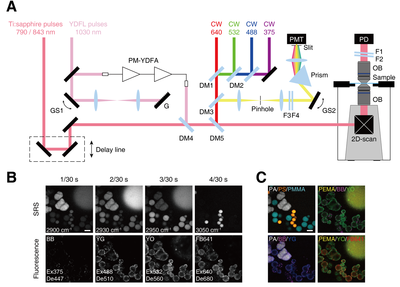
図1 開発したラマン・蛍光統合イメージングシステムによる超多重イメージング。A: システムの模式図。誘導ラマン散乱を誘起するためにチタンサファイア(Ti:sapphire)レーザーとイッテルビウム添加ファイバーレーザー(YDFL)で発生する2色パルスを用いる。YDFLパルスの一部の波長成分を回折格子(G)で抽出する。抽出する波長はガルバノスキャナ(GS1)で高速に選択できる。抽出した波長成分を偏波保持イッテルビウムファイバー増幅器(PM-YDFA)で増幅する。蛍光励起用に4つの波長(640 nm, 532 nm, 488 nm, 375 nm)のレーザーを用いる。これら全ての光をダイクロイックミラー(DM)で合波し、顕微鏡に導入する。顕微鏡ではレーザー光に対してレーザー走査を行ったのちにレーザー光を対物レンズ(OB)で試料に集光する。試料透過光をフォトダイオード(PD)で検出することでSRS信号を得ると同時に、試料からの蛍光を光電子増倍管(PMT)で検出する。蛍光検出の光路にプリズムとガルバノスキャナ(GS2)を設置して蛍光検出波長を制御する。B: SRS及び蛍光による高速超多重イメージング例。33ミリ秒ごとにSRS像及び蛍光像を同時取得しつつ、SRSで検出する分子振動周波数、蛍光励起波長(Ex)、蛍光検出波長(De)を切り替えることで、133ミリ秒で4種の樹脂ビーズ(PA, PEMA, PMMA, PS)のSRS像と4種の蛍光ビーズ(BB, YG, YO, PB641)の多重イメージングに成功した。C: Bの画像から成分分離処理・カラー合成処理によって得られた多色画像。スケールバー:10 µm。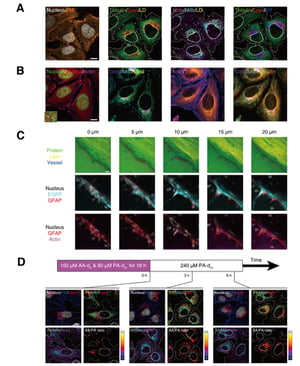
図2 様々な生体試料の超多重イメージング例。A: 生細胞の8多重イメージング。画像取得時間:30秒。ラマンプローブによりミトコンドリア(Mito)、リソソーム(Lyso)、脂肪滴(LD)、小胞体(ER)を染色し、蛍光分子により核(Nucleus)、細胞膜(PM)、微小管(Tubulin)、アクチン(Actin)を染色して観察した。B: 無標識SRS 2色・蛍光6色による生細胞の8色イメージング。画像取得時間:2秒。SRSでタンパク(Protein)及び脂質(Lipid)を、蛍光で核(nucleus)、ミトコンドリア(Mito)、細胞膜(PM)、ゴルジ体(Golgi)、微小管(Tubulin)、アクチン(Actin)を観察した。C: マウス脳組織切片の3次元7色イメージング。画像取得時間:1層あたり16秒、計80秒。SRSでタンパク(Protein)、脂質(Lipid)、血管(Vessel)を、蛍光で核、蛍光タンパク(EGFP)、グリア線維性酸性蛋白質(GFAP)、アクチンを観察した。D: 生細胞の7色代謝イメージング。画像取得時間:2秒。SRSで重水素標識した2種の脂肪酸(パルミチン酸(PA-d31)及びアラキドン酸(AA-d8))を観察し、蛍光で核(Nucleus)、ミトコンドリア(Mito)、細胞膜(PM)、リソソーム(Lyso)、アクチン(Actin)を観察した。PA-d31とAA-d8を18時間投与し、その後AA-d31を培地から除去して観察した。PA-d31とAA-d8の信号強度比が細胞ごとに大きく異なることが見て取れ、これは細胞ごとの代謝状態の違いを反映していると考えられる。スケールバー:10 µm。
プレスリリース本文:/shared/press/data/setnws_202107281130304506711013_050537.pdf
iScience:https://www.cell.com/iscience/fulltext/S2589-0042(21)008002
慶応大学:http://www.med.keio.ac.jp/press-releases/2021/
科学技術振興機構:https://www.jst.go.jp/pr/announce/20210727-5/index.html
おすすめ記事
本件に関連する記事はこちら

