・アンチセンスオリゴヌクレオチド (ASO) は、遺伝子の発現を抑制して作用する核酸医薬であるが、速やかに体外へ排出されるという欠点がある。
・ヒト非小細胞肺がん細胞株であるA549-Lucを同所移植したマウスを用いて、ASO製剤(asTUG1)の局所滞留性を IVIS で評価した。
・asTUG1をそのまま、または高分子ナノミセル(スマートナノマシン)に搭載して、A549-Luc 移植マウスに気管支内投与すると、前者では肺の他に肝臓、脾臓、腎臓にも分布が観られたが、後者では肺だけに薬剤の集積が確認できた。
・将来的に吸入剤としての肺がん治療薬の創出に繋がる結果となった。
・Advanced Therapeutics 2020,3,1900123に掲載済。DOI: 10.1002/adtp.201900123
公益財団法人川崎市産業振興財団 ナノ医療イノベーションセンター(センター長:片岡一則、所在地:川崎市川崎区、略称:iCONM)は、東京大学大学院工学系研究科マテリアル工学専攻・宮田完二郎准教授(ナノ医療イノベーションセンター客員研究員)を講師に招いた第58回COINSセミナー(演題:核酸医薬の実用化に資するナノマシン~送達困難な組織への核酸医薬デリバリー)を 5/10に開催しました。重篤な疾病は、特定の機能性タンパク質が過剰発現したり、また逆に発現しなかったりすることで発症します。このタンパク質の発現を制御する核酸医薬(注1)には、アンチセンス核酸 (ASO)、低分子干渉RNA (siRNA)、アプタマー、デコイなど様々なものがあり、抗体医薬に比べて安価に製造できるということで注目されています。しかしながら、生体内で不安定であることや、体外への排出速度が速いなど、生物学的利用率 (BA) が低いという欠点があります。宮田先生は本セミナーにおいて、ナノ医薬技術が核酸医薬の欠点を補い、用途に応じて設計されたナノミセル(注2)や、世界最小サイズとなるユニットポリイオンコンプレックス(uPIC)(注3)が、標的となる組織に選択的かつ効果的に薬剤を届ける上で有用であることを実例で示しました。本セミナーでは、総論として、以下の宮田先生の研究に関わる6論文について解説しました。
1.世界最小スケールの核酸搭載ナノ医薬(uPIC)による難治がんの標的化:“In vivo rendezvous of small nucleic acid drugs with charge-matched block catiomers to target cancers”, Nature Communications, 10, 1894 (2019); https://doi.org/10.1038/s41467-019-09856-w
2.化学修飾型核酸の利用により、さらに優れた機能を発揮するuPIC:“Structural tuning of oligonucleotides for enhanced blood circulation properties of unit polyion complexes prepared from two-branched poly(ethylene glycol)-block-poly(l-lysine)”, Journal of Controlled Release, 330, 812 (2021); https://doi.org/10.1016/j.jconrel.2021.01.001
3.血糖値制御により血液-脳関門(BBB)を突破するグルココース被覆ナノキャリア:”Glycaemic control boosts glucosylated nanocarrier crossing the BBB into the brain”, Nature Communications, 8, 1001 (2017);https://doi.org/10.1038/s41467-017-00952-3
4.グルコース被覆ナノキャリアにより、BBBを突破して脳内にアンチセンス核酸をデリバリーすることに成功:”Systemic brain delivery of antisense oligonucleotides across the blood-brain barrier with a glucose-coated polymeric nanocarrier”, Angewandte Chemie International Edition, 59, 8173 (2020);https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201914751
5.化学構造が精密調整された両親媒性ポリアスパラギン誘導体を用いたmRNAデリバリーにより、マウス脳内で効率的なゲノム編集を誘導:”Fine tuning of hydrophobicity in amphiphilic polyaspartamide derivatives for rapid and transient expression of messenger RNA directed toward genome engineering in brain”, ACS Central Science, 5, 1866 (2019);https://doi.org/10.1021/acscentsci.9b00843
6.ナノミセル化技術により、気管支内投与されたアンチセンス核酸の肺組織滞留を大幅に改善することに成功:“A 50-nm-sized micellar assembly of thermoresponsive polymer-antisense oligonucleotide conjugates for enhanced gene knockdown in lung cancer by intratracheal administration”, Advanced Therapeutics, 3, 1900123 (2020);https://doi.org/10.1002/adtp.201900123
この中で、6番目の気管支内投与によるマウス同所移植ヒト非小細胞肺がんへのASO搭載ナノミセルの集積性に関する研究報告について、ここに情報提供させて頂きます。その他につきましては、プレス発表済です。
呼吸器系疾患における吸入剤の貢献は大きく、気管支喘息や慢性呼吸器系疾患 (COPD) においては既に有効な吸入剤が上市されており、患者さんの生活の質を大きく改善しました。宮田先生らは、がん細胞が持つ Taurine Upregulated Gene 1 (TUG1) という遺伝子(注4)に着目し、そのアンチセンス核酸 (ASO) である asTUG1 を、ヒト非小細胞肺がん細胞を同所移植したマウスに気管支内投与し、TUG1の発現を抑制する研究を行いました。前述のとおり、ASOは投与後速やかに体外へ排出される性質があり、気管支投与においても肺には留まらずに肝臓や腎臓に速やかに移行して体外へ排出されてしまいます(図1)。そこで、高分子ナノミセルに 蛍光標識asTUG1 を搭載して(図2)、ヒト非小細胞肺がん細胞(A549-Luc)から作成された同所移植モデルマウスに気管支内投与しました。その結果、肺に長時間同ASO製剤を滞留させることに成功しました(図3)。さらに、肺がん細胞内で標的遺伝子をノックダウンすることにも成功しました(図4)。
本研究は、将来的に、肺がん治療のための吸入剤創出に繋がることが期待されます。
図1:
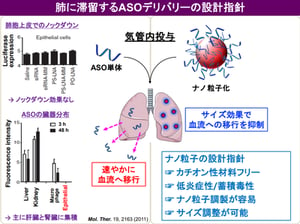
図2: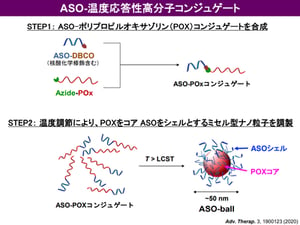
図3:
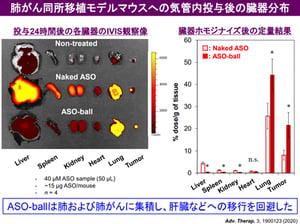
図4: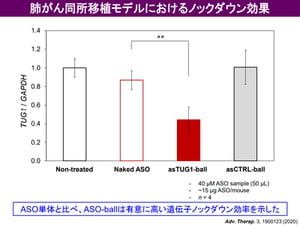
注1:核酸医薬:疾病の原因となる遺伝子 (DNA) やそこから転写された mRNA に作用し、遺伝情報の伝達や発現を制御することで疾病治療を行う医薬品。遺伝情報となる核酸に結合して翻訳を阻害するアンチセンス医薬品や mRNAを切断して機能しなくさせる siRNAなど様々なものが研究開発されている。参考:http://www.nihs.go.jp/mtgt/section-1/related%20materials/0-19.pdf (国立医薬品食品衛生研究所公開資料)
注2:高分子ナノミセル:様々な機能を持つ両親媒性ポリマーを水中で会合させることにより形成される数十nm径のミセル(ナノミセル)。
Cabral, K. Miyata, K. Osada, K. Kataoka, “Block copolymer micelles in nanomedicine applications” Chem. Rev.118 (14) 6844-6892 (2018) (DOI: 10.1021/acs.chemrev.8b00199)
注3:uPIC(unit polyion complex):1分子の核酸医薬と1~2分子のY字型ブロックコポリマーで構成されるナノ医薬品。サイズが約18 nmであり、生体内で遊離のY字型ブロックコポリマーと動的平衡状態にある。以下の YouTube 動画参照 https://www.youtube.com/watch?v=E90zF6_gL28uPICの動的平衡を最初に報告した論文:S. Watanabe, K. Hayashi, K. Toh, H. J. Kim, X. Liu, H. Chaya, S. Fukushima, K. Katsushima, Y. Kondo, S. Uchida, S. Ogura, T. Nomoto, H. Takemoto, H. Cabral, H. Kinoh, H. Y. Tanaka, M. R. Kano, Y. Matsumoto, H. Fukuhara, S. Uchida, M. Nangaku, K. Osada, N. Nishiyama, K. Miyata and K. Kataoka, ”In vivo rendezvous of small nucleic acid drugs with charge-matched block catiomers to target cancers” Nature Communications 10, 1894 (2019) (https://doi.org/10.1038/s41467-019-09856-w)
注4:TUG1 (Taurine Upregulated Gene 1):特定のがん細胞で過剰発現する長鎖非翻訳RNA。膵臓がんや悪性脳腫瘍などで、TUG1の発現抑制による治療効果が認められている。
公益財団法人川崎市産業振興財団について
産業の空洞化と需要構造の変化に対処する目的で、川崎市の100%出捐により昭和63年に設立されました。市場開拓、研究開発型企業への脱皮、それを支える技術力の養成、人材の育成、市場ニーズの把握等をより高次に実現するため、川崎市産業振興会館の機能を活用し、地域産業情報の交流促進、研究開発機構の創設による技術の高度化と企業交流、研修会等による創造性豊かな人材の育成、展示事業による販路拡大等の事業を推進し、地域経済の活性化に寄与しています。
https://www.kawasaki-net.ne.jp/
ナノ医療イノベーションセンターについて
ナノ医療イノベーションセンター(iCONM)は、キングスカイフロントにおけるライフサイエンス分野の拠点形成の核となる先導的な施設として、川崎市の依頼により、公益財団法人川崎市産業振興財団が、事業者兼提案者として国の施策を活用し、平成27年4月より運営を開始しました。有機合成・微細加工から前臨床試験までの研究開発を一気通貫で行うことが可能な最先端の設備と 実験機器を備え、産学官・医工連携によるオープンイノベーションを推進することを目的に設計された、世界でも類を見ない非常にユニークな研究施設です。
https://iconm.kawasaki-net.ne.jp/
センター・オブ・イノベーション (COI) プログラムについて
COIプログラムは、文部科学省・科学技術振興機構の下で進められている研究開発プログラムで、将来社会に潜在する課題から、現在取り組むべき異分野融合・連携型の研究開発テーマをバックキャストして設定しています。企業や大学だけでは実現できないイノベーションを産学連携で実現する拠点が全国に18か所設立されました。川崎拠点は、その中で唯一、大学でなく自治体系研究所が管理するCOI拠点であり、そこで実施する研究プロジェクトを、COINS (Center of Open Innovation Network for Smart Health) と呼んでいます。
COI: https://www.jst.go.jp/coi/
COINS : https://coins.kawasaki-net.ne.jp/
プレスリリース本文:PDFファイル
おすすめ記事
本件に関連する記事はこちら
難治性癌の治療を目的とした核酸医薬搭載可能な世界最小スケールのナノ医薬品の開発:マテリアル工学専攻 宮田完二郎 准教授ら
生体内で宇宙船の様に核酸医薬とランデブーし、ドッキングしながら脳腫瘍に到達して標的治療を行うナノマシンを開発:東京大学未来ビジョン研究センター 片岡一則教授、マテリアル工学専攻 宮田完二郎准教授ら