1.発表者:
岡本 晃充(東京大学 大学院工学系研究科化学生命工学専攻 教授)
森廣 邦彦(東京大学 大学院工学系研究科化学生命工学専攻 助教)
2.発表のポイント:
◆ 1対のヘアピン型DNAが特定のがんを殺すことを発見した。
◆がんで過剰発現するマイクロRNAがきっかけになって人工DNAが集合体を形成し、これが自然免疫を惹起する。
◆これまでの抗がん剤とは全く異なるメカニズムで人工DNAががんを殺すことができる。
3.発表概要:
東京大学大学院工学系研究科の森廣邦彦助教、岡本晃充教授らの研究グループは、1対のヘアピン型DNA(注1)が、がんで過剰発現するマイクロRNA(注2)を起点にして集合体を形成し、がん細胞が死滅する現象を発見した。
がんの治療には、外科手術のほかに、薬物や放射線による治療が試みられる。これまでにもさまざまな抗がん剤が開発されてきたが、効きにくいなどの理由で、従来型とは異なるメカニズムで機能する抗がん剤が求められている。
本研究グループは、1対のヘアピン型DNAがマイクロRNAをきっかけにして集合体を形成することに着目し、これをがんに特徴的なマイクロRNAに作用させることによってそのがん細胞を死滅させることができることを発見した。さらに、その細胞死をきっかけに免疫細胞を誘導し、がん組織の成長を妨げることができることがわかった。
今回の結果は、従来型の抗がん剤とは全く異なる作用メカニズムをもつ新規の抗がん剤設計のアイデアを提供するものである。また、コロナ禍以降に着目されている核酸医薬(注3)と比較しても、今回の人工DNA集合体はこれまでにないメカニズムによる効き方であり、新しいカテゴリーの核酸医薬をもたらすことが期待される。
本研究成果は、2022年12月20日(米国東部標準時)に米国化学会誌「Journal of The American Chemical Society」のオンライン版に掲載された。
4.発表内容:
<研究の背景>
コロナ禍を経て、ワクチンにも用いられた核酸が新たな医薬品の候補として俄然注目を浴びている。核酸医薬は、がんや遺伝性疾患、ウイルス性感染症など治療が難しい疾患に対する医薬品開発において期待されるものである。作用機序が明確で、特異性や安全性を高められるのも特徴である。また、細胞の培養によって製造される抗体医薬とは異なり、核酸医薬は化学合成によって容易に製造でき、労力のかかる阻害剤の探索も必要ない。これまでの核酸医薬では、「アンチセンス」と「siRNA」(注3)が大半を占めるが、それらはmRNAの翻訳阻害や分解を目的としてきた。
がんは今もなお、制圧すべき疾病の最上位にある。化学療法で用いられる抗がん剤は多様化しているものの、効かないがん、耐性を持ったがんなど難治性とされるがんが多く残されている。従来品とは異なる作用機序で働く抗がん剤が開発されれば、今まで効かなかったがんにも効果をもつ可能性がある。核酸医薬は抗がん剤の候補になりうるが、これまで研究されてきた作用機序では抗がん効果が小さく、新たな作用機序で働く核酸医薬の開発が求められていた。
<研究内容>
人工核酸は、細胞外・細胞内のさまざまな核酸センサーに認識され、自然免疫応答を刺激することができるため、がん免疫治療材料として注目されている。しかし、がん細胞に対する選択性が低いため、全身性の免疫毒性が強く、人工核酸分子をがん免疫療法に利用することは困難であった。この課題を解決するために、本研究グループは、がん選択的に免疫活性化を行い、細胞傷害性を誘導することができるヘアピンDNA集合技術、つまり、設計した化学合成短鎖ヘアピン核酸対(oHPs)(注1)がさまざまながん細胞で過剰発現している細胞内マイクロRNA-21(miR-21)(注2)が引き金になってoHPsがハイブリダイゼーション連鎖反応(HCR)を引き起こして集合体を作ることを発見した。がん細胞の中で生じたoHPs集合体産物は、cGAS-STING経路(注4)を経由してI型インターフェロンの発現を誘導し、最終的に細胞死へ至らしめた。ヒト子宮頸がん由来細胞(HeLa)、ヒトトリプルネガティブ乳がん由来細胞(MDA-MB-231)、マウス悪性黒色腫(メラノーマ)由来細胞(B16)など、miR-21が過剰発現して、かつSTINGが十分に発現するがん細胞に対してoHPsは有効に作用した。さらに、B16担持マウスに対してoHPsを局所注射した結果、腫瘍の成長が強く抑制される様子が観察された。これまで長い間、外部からの二本鎖DNAは、細胞内外のさまざまなDNAセンサーに認識されて自然免疫反応を活性化することからがん免疫療法に有効であると考えられてきたが、DNAの腫瘍微小環境に対する選択性の低さとそれに伴う全身的な免疫毒性のため抗がん剤としてのDNAの利用は強く敬遠されてきた。本研究グループが見出した短いDNA oHPsによるmiR-21過剰発現条件下での細胞内二本鎖形成は、標的腫瘍退縮に向けた選択的な免疫増幅・増強回路として利用された最初の例であり、既知の核酸医薬とは全く異なる機序を示す新分類の核酸医薬候補を与えた。
<展望と社会的意義>
今回開発したoHPsは、従来の抗がん剤の効き方と異なるため、それらを補完する役割が期待される。今後は、oHPsの薬剤としての有効性をさまざまながん種で検討して、特定のがんを標的にした効果的な抗がん性核酸医薬の誕生に向けた研究開発が進められることが期待される。
<謝辞>
本研究は、日本学術振興会科学研究費補助金 挑戦的研究(萌芽)(21K19040)、若手研究(19K15408)、新学術領域研究(18H05504および20H04698)、日本医療研究開発機構(AMED)橋渡し研究プログラム シーズA「トリプルネガティブ乳がんに対する新分類の核酸医薬の開発」(JP22ym0126805・支援拠点:東京大学拠点)およびJST ACT-X(JPMJAX191I)の助成を受けて行われた。
5.発表雑誌:
雑誌名:「Journal of The American Chemical Society」
論文タイトル:Oncolytic Hairpin DNA Pair: Selective Cytotoxic Inducer through MicroRNA-Triggered DNA Self-Assembly
著者:Morihiro, Kunihiko; Osumi, Hiraki; Morita, Shunto; Hattori, Takara; Ohashi, Riuko; Okamoto, Akimitsu
DOI番号:10.1021/jacs.2c08974
URL:https://doi.org/10.1021/jacs.2c08974
6.用語解説:
(注1)1対のヘアピン型DNA、化学合成短鎖ヘアピン核酸対(oHPs)
およそ50塩基長のヘアピン型の構造をもつ、化学的に合成されたDNAのペア。マイクロRNAがきっかけとなり連鎖的にヘアピン構造が開いていき、長い二重らせん集合体構造を形成する。
(注2)マイクロRNA、miR-21
およそ20~25塩基長のRNA。タンパク質へ翻訳されない短いRNA。miR-21はマイクロRNAのひとつで、miR-21が過剰に発現するがんがある。
(注3)核酸医薬、「アンチセンス」、「siRNA」
核酸構造から成る化学合成医薬品。従来の低分子医薬や抗体医薬では狙いにくい疾患をターゲットにすることできる。アンチセンス法では、タンパク質へ翻訳されるメッセンジャーRNAに結合して翻訳を阻害する核酸医薬品が用いられる。siRNA法では、メッセンジャーRNAに結合して分解へ誘導する核酸医薬品が用いられる。
(注4)cGAS-STING経路
病原体に由来する異種の長い二本鎖DNAが細胞質に入ったときに発動する免疫経路のひとつ。cGASタンパク質が二本鎖DNAを認識して結合すると、膜貫通型タンパク質STINGが小胞体からゴルジ体へ移動して、結局I型インターフェロンの産生が誘導される。cGAS-STINGを介した自然免疫応答は、さまざまな生理現象や病変に関わると言われている。
7.添付資料:
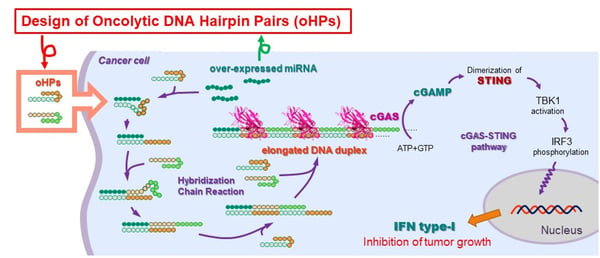
図1. 人工核酸oHPsによる細胞内集合体形成。特定の配列のマイクロRNA(miRNA)が過剰に発現しているがん細胞の中にoHPsが入るとマイクロRNAを起点にしてハイブリダイゼーション連鎖反応がおこり、長い二本鎖DNAを形成する。
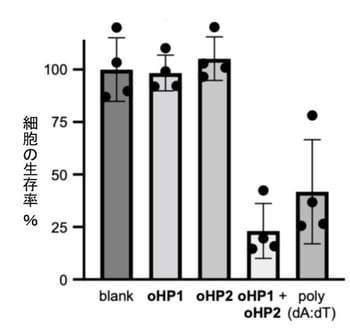
図2. がん細胞の死滅(ヒト子宮頸がん細胞HeLaの例)。人工DNAoHPsがペア(oHP1+oHP2)になって働くと、miR-21を過剰に発現しているHeLa細胞は死滅した(図中右から2番目の棒グラフ)。長い二本鎖DNA poly(dA:dT)を投与するよりも効果が高い。
プレスリリース本文:PDFファイル
Journal of The American Chemical Society:https://pubs.acs.org/doi/10.1021/jacs.2c08974
おすすめ記事
本件に関連する記事はこちら
細胞同士の相互作用を1細胞解析するための光反応性表面を開発 ―がん免疫療法への応用に期待―
精密分子設計による高感度MRI分子プローブの開発 〜早期診断に向けたがん関連酵素活性の生体内リアルタイム計測〜