1.発表者:
野田 悠太 (研究当時:東京大学 大学院工学系研究科 化学生命工学専攻 博士課程3年)
岡田 俊平 (研究当時:東京大学 大学院工学系研究科 化学生命工学専攻 特任研究員)
鈴木 勉 (東京大学 大学院工学系研究科 化学生命工学専攻 教授)
2.発表のポイント:
◆セレン含有タンパク質(注1)であるセレノプロテインN (SELENON)は、セレンの高い還元作用を用いて、酸化ストレスから細胞を保護する役割がある。SELENONの発現制御は骨格筋の形成や機能に重要な役割を担っている。本研究は、筋分化の過程において、SELENON遺伝子が以下に示す2つの機構で発現制御されることを明らかにした。
◆筋分化の前期から中期にかけて、SELENONの前駆体mRNAの二次構造が変化し、RNA編集(注2)が導入されることで、異常なmRNAスプライシング(注3)が抑制され、SELENONタンパク質の発現が維持されることが判明した。
◆SELENONは21番目のアミノ酸として知られるセレノシステイン(Sec)を含んでおり、Secはリコーディング(注4)と呼ばれる特殊翻訳によって取り込まれる。筋分化の中期以降はリコーディング活性が低下し、SELENONの発現が低下することが明らかになった。リコーディング制御はこれまで報告されていない新規の現象であり、遺伝子発現制御の概念を大きく拡張させるものである。
◆本研究成果は、ヒト骨格筋形成のさらなる理解に加え、将来的にはSELENON関連疾患(注5)の治療法の開発や、加齢などによる筋力低下の改善につながることが期待される。
3.発表概要:
セレノプロテインN (SELENON)は活性中心に重金属であるセレンを含むセレン含有タンパク質である。骨格筋が分化する過程において、細胞が一時的な酸化ストレスに曝されるが、SELENONはセレンの高い還元作用を用いて、酸化ストレスから細胞を保護する役割がある。SELENON遺伝子の変異はSELENON関連疾患と総称される重篤な筋疾患を引き起こすことから、SELENON遺伝子の正確な発現制御が骨格筋の形成や機能に不可欠である。骨格筋が分化する初期段階ではSELENONの発現が高く保たれ、分化が進むにつれてSELENONの発現が下がることが知られていたが、そのしくみはよくわかっていなかった。
東京大学大学院工学系研究科化学生命工学専攻の野田悠太大学院生(研究当時)、岡田俊平特任研究員(研究当時) 、鈴木勉教授のグループは、ヒトの筋芽細胞が骨格筋へと分化する前期と中期において、SELENONの発現が高く保たれ、後期において、発現量が徐々に低下するしくみを明らかにした(図1)。そのしくみから、新規の遺伝子発現制御機構が見つかった。
SELENONのmRNA前駆体にはAlu反復配列(注6)が含まれており(図2)、mRNAスプライシングの過程でこの一部がエキソンとして取り込まれるとナンセンス変異依存mRNA分解機構(nonsense mediated mRNA decay, NMD)(注7)により発現が抑制される(図2)。筋分化の前期から中期にかけて、RNA結合タンパク質とRNA修飾が、序列的に作用することで、Alu反復配列のエキソン化が抑制され(図1)、SELENONタンパク質の発現が維持されることが判明した(図3)。
2つ目の制御機構は、特殊翻訳の制御である(図1)。SELENONはセレン含有タンパク質であり、活性中心にセレノシステイン (Sec)残基を有している(図4A)。Secは終止コドンの1つであるUGAコドンによりコードされ、リコーディングと呼ばれる特殊なタンパク質合成によって取り込まれる。研究グループは、筋分化の中期から後期にかけて、多くのリコーディングに関与する因子の発現が低下することを見出した(図4BC)。特にSecを受容したtRNASecが顕著に減少する(図4D)ことで、UGA/Secコドンのリコーディングの効率が低下していることを明らかにした。この結果、筋分化の後期では、活性のあるSELENONが合成されず、またUGA/Secコドンが未成熟終止コドンとして認識されることで、SELENON mRNAはNMDの機構により分解され、発現量が低下することが明らかとなった。
本研究により明らかとなった段階的な転写後制御機構により、筋分化の過程でSELENONの発現が精密に制御されることが示された。今後は、これらの制御機構の生理的意義を明らかにすることで、骨格筋形成のさらなる理解に加え、将来的にはSELENON関連疾患の治療法の開発や、加齢などによる筋力低下の改善につながることが期待される。また本研究で示されたリコーディングの制御はこれまで報告されていない新規の現象であり、遺伝子発現制御機構の理解において大きな概念的進歩をもたらすものである。本研究成果は5月6日(英国夏時間)に科学誌「Nature Communications」に掲載されました。
4.発表内容:
骨格筋は多核化した筋繊維の束で構成されており、損傷を受けると再生能力を持つ筋衛星細胞が活性化して増殖し、筋芽細胞に分化する。筋芽細胞は互いに融合して多核の筋管細胞を形成し、最終的に成熟した筋繊維を形成する(図1)。この過程では小胞体ストレスが誘起されることにより活性酸素 (ROS)が大量に発生し、分化のための重要なシグナル伝達に用いられる。しかし過剰なROSは酸化ストレスを引き起こし、細胞を損傷させるため、筋芽細胞はセレン含有タンパク質などによる抗酸化システムを発動させ、酸化還元状態のバランスを保つことで骨格筋の正常な分化を保証することが知られている。
セレン含有タンパク質は、システインの硫黄が微量な金属元素であるセレン(原子番号34)に置き換わったセレノシステイン(Sec)残基を有したタンパク質の総称である。ヒトではこれまでに25種類のセレン含有タンパク質が同定されており、そのほとんどがSecの高い求核性による酸化還元特性を利用して、抗酸化作用や酸化還元シグナル伝達に関与している。その中でも、SELENONは骨格筋との重要な関係性が明らかになっている。SELENONは酵素活性部位にSec残基を持つ糖タンパク質であり、小胞体の膜上に局在し、その高い還元作用で酸化ストレスに対して細胞を保護する役割を担っている。またSELENONは小胞体内のCa2+濃度が低い時に、Ca2+ポンプであるSERCAを還元し、その活性を維持することで、細胞内Ca2+濃度の調節に重要な役割を担っている。SELENONは骨格筋の形成や構造の維持に必須であることが知られており、SELENON遺伝子の変異によりSELENON関連ミオパシーと呼ばれる進行性で重篤な筋疾患を引き起こす。しかしこの疾患が生じる詳細な分子機構は未だ不明であり、根治的な治療法が存在しないのが現状である。骨格筋が分化する過程で、筋芽細胞が互いに融合し多核の筋管細胞を形成する際に、SELENONの発現量が減少する(図1)ことが知られている。したがってSELENONの発現調節は骨格筋形成に重要な役割を持つと考えられているが、その詳細な機構や生理的意義は不明である。
本研究グループは、骨格筋が分化する過程において、SELENONの発現がどのように調節されているかを明らかにすることを目標とし、特に転写後過程における制御機構に着目して研究を行った。実験材料として、ヒト由来の不死化した筋芽細胞株であるHu5/KD3細胞を用い、in vitroでの筋分化過程における遺伝子発現の解析および生化学を駆使した解析により、転写後における2つの機構を明らかにした(図1)。
1つ目の機構は、mRNAの成熟化過程において、Alu反復配列の一部がエキソンとして取り込まれるAluエキソン化の制御である(図2)。SELENON mRNAの第2イントロン内に存在するアンチセンス鎖のAlu配列はスプライシングに必要なシグナルを有するため、その一部がしばしばエキソンとして取り込まれる現象(Aluエキソン化)が知られていた(図2AB)。この異常なmRNAには未成熟終止コドン(PTC)が出現し、NMDと呼ばれるmRNAの品質管理機構により分解される(図2BC)。ヒト組織間で比較すると、SELENON mRNAのAluエキソン化は骨格筋で顕著に亢進している。したがって骨格筋では分化の過程でAluエキソン化によるmRNAの分解を介してSELENONの発現量を低下する機構が考えられた。そこで、Hu5/KD3細胞の分化の過程でこの機構を詳細に解析した。ウェスタンブロッティングでタンパク質の発現変動を調べると、確かに分化に伴いSELENONの発現が減少する様子が観察された(図3A)。また、SELENON mRNAのAluエキソン化は筋分化の中期から後期にかけて促進されていることがわかった(図3B)。そこで、Aluエキソン化を制御する因子として報告があり、分化の過程で発現量が低下するhnRNP CとADAR1(図3A)に着目した。RNA結合タンパク質であるhnRNP Cはアンチセンス鎖のAlu配列が持つ連続したウリジン残基に結合することが知られている。実際にRNA干渉法によりhnRNP Cの発現を抑制すると、Aluエキソン化が増加した(図2C)ことから、hnRNP CはSELENON mRNAのAluのエキソン化を抑制する働きが明らかとなった。
次に、分化中期にかけて、hnRNP Cの定常状態量が減少すると(図3A)、ADAR1によるAluエキソンの5’スプライス部位 (5’ss)周辺へのイノシン (I)修飾が増加することが判明した(図3C)。この部位はU1 snRNAが5’ssを認識するコンセンサス配列であり(図3D)、I修飾がU1 snRNAのシュードウリジン(Ψ)との塩基対形成を妨げると予想された。そこで、SELENON mRNAの第2イントロン全長を含むレポーター遺伝子を作成し、細胞内でスプライシングの効率を調べた。5’ss 周辺のI修飾部位を、Iと化学構造の類似したグアノシン (G)に置換したレポーターを作成したところ、エキソン化が顕著に抑制されていた。以上の結果から、ADAR1による5’ss周辺へのI修飾がU1 snRNAの認識を弱めることで、Aluエキソン化を抑制するという、新規のエピトランスクリプトミクス(注8)的な遺伝子発現制御モデルが提唱された。以上の解析結果から、SELENONの発現が筋分化の前期と中期で維持される(図3A)のは、hnRNP CによるAlu配列への結合と、ADAR1によるAluエキソン5’ssへのI修飾という、2つの異なる機構が序列的に働くことでAluエキソン化が抑制される(図1)からであると結論付けた。そして分化後期には、ADAR1の発現が低下する(図3A)ことでI修飾も低下し(図3C)、Aluエキソン化が促進される(図3B)ことで、正常なmRNAが減少しSELENONタンパク質の定常状態量が減少すると考えられる。また、Aluエキソンを含む異常なmRNAはNMDで分解される。
2つ目の機構は、翻訳過程における制御である(図1)。Hu5/KD3細胞の筋分化の中期から後期にかけて、完全長SELENONタンパク質の発現低下に伴い、Secのリコーディング部位であるUGAコドンで終結した短い翻訳産物が増加していることが判明した(図3A, 4A)。そこで、Hu5/KD3細胞の筋分化過程での継時的なRNA-seq解析を行った結果、多くのUGA/Secリコーディング因子が分化に伴い発現が低下していることがわかった(図4B)。さらに、セレニウム転移酵素SEPSECSについてはRNA-seqでは有意な減少は見られなかったものの、Day3以降にタンパク質の定常状態量が大きく減少することが明らかになった (図4C)。そこで、Hu5/KD3細胞分化のDay0 (分化前)とDay5 (分化後)のtotal RNAからtRNASecを単離精製し、RNase T1で消化した後に、高感度なキャピラリー液体クロマトグラフィー質量分析法 を用いて3’末端に結合しているアミノ酸を詳細に解析した。この結果、Day0ではSec-tRNASecの割合は全体の33.5%を占めていたが、Day5では、その割合が14.4%と大きく減少しており、代わりにpSer-tRNASecが蓄積している様子が観測された(図4D)。したがって筋分化の後期においてはpSerからSecの変換過程が律速となり、Sec-tRNASecが枯渇するために、UGA/Secコドンのリコーディング効率が低下し、活性のあるSELENONが合成されないと結論付けた。またUGA/Secコドンは未成熟終止コドンとして認識されSELENON mRNAがNMDにより分解されることで、更なるSELENONタンパク質の発現低下が導かれる。
以上より、本研究では段階的な転写後発現制御機構により、筋分化の過程でSELENONの発現が精密に制御されていることが示された。近年、RNA修飾によるエピトランスクリプトミクス制御が生命科学に大きな潮流を生み出しているが、I修飾はヒトの転写産物中に最も豊富に存在するRNA修飾の1つである。I修飾の90%以上がAlu反復配列上に存在することが知られているが、その機能は十分に理解されていない。本研究は、SELENON mRNAのI修飾がU1 snRNAの認識を妨げることで、mRNAスプライシングを制御することを示した最初の例であり、I修飾の機能を理解する上での新たな視点を提供している。さらに、セレン含有タンパク質の発現に必須なUGA/Secのリコーディングに関しては、そのしくみは詳しく調べられてきたものの、その制御がどのような生命現象と関連しているかは知られていなかった。本研究は、細胞が分化する過程でUGA/Secリコーディングが制御されることを示した初めての成果である。今後これらの制御機構の生理的意義を明らかにすることで、将来的にはSELENON関連疾患の治療法の開発や、加齢などによる筋力低下の改善につながることが期待される。
本研究は、日本学術振興会(JSPS)の基盤研究(S)「RNAエピジェネティックスと高次生命現象」(代表:鈴木 勉、26220205)、基盤研究(S)「RNA修飾の変動と生命現象」(代表:鈴木 勉、18H05272)、新学術領域研究(研究領域提案型)「ncRNAのケミカルタクソノミ」(代表:鈴木 勉、26113003)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木 勉、JPMJER2002)の支援を受けて実施された。
5.発表雑誌:
雑誌名:「Nature Communications」
論文タイトル:Regulation of A-to-I RNA editing and stop codon recoding to control selenoprotein expression during skeletal myogenesis
著者:Yuta Noda, Shunpei Okada and Tsutomu Suzuki
DOI番号:10.1038/s41467-022-30181-2
アブストラクトURL:https://www.nature.com/articles/s41467-022-30181-2
6.用語解説:
(注1) セレン含有タンパク質
システインの硫黄がセレン (Se)に置き換わったセレノシステイン (Sec) 残基を有するタンパク質。Secは21番目のアミノ酸と呼ばれている。ヒトではこれまでに25種類のセレン含有タンパク質が同定されており、そのほとんどがSecの高い求核性による酸化還元特性を利用して、抗酸化作用や酸化還元シグナル伝達に関与していると考えられている。しかし機能が明らかになっているセレン含有タンパク質は少ない。
(注2) RNA編集
RNA修飾の一種であり、アデノシン(A)を脱アミノ化してイノシン(I)へと変換する機構。A-to-I RNA編集(エディティング)と呼ばれる。核内でADAR1およびADAR2と呼ばれる酵素が触媒し、RNAが二本鎖を形成した場所に導入される。I修飾はグアノシン(G)と化学構造が類似しているため、シトシン(C)と塩基対形成が可能であり、mRNA上の塩基情報がAからGへと変換されて認識されることから、RNA編集と呼ばれる。タンパク質の翻訳領域内においてはアミノ酸の変化、イントロンにおいては選択的スプライシングの変化など様々な機能を持ち、遺伝子発現の制御に関与していることが知られている。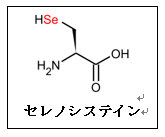
(注3) mRNAスプライシング
転写により合成されたmRNA前駆体には、翻訳されて最終的にアミノ酸配列へと変換される領域 (エキソン)と、スプライシングの過程で取り除かれる部分 (イントロン)が交互に並んで構成されている。mRNA前駆体から、イントロンが除去された後にエキソン同士がつながる一連の反応をmRNAスプライシングと呼ぶ。この反応は、U1, U2, U4, U5, U6 snRNAと呼ばれる5種の核内低分子RNAと多数の関連タンパク質からなるスプライソソームと呼ばれる複合体群が、序列的に働くことで触媒される。
(注4) リコーディング
Secは終止コドンの1つであるUGAコドンによりコードされ、リコーディングと呼ばれる特殊なタンパク質合成によってタンパク質へと取り込まれる。Secには専用のアミノアシルtRNA合成酵素がなく、tRNASecには、まずセリルtRNA合成酵素 (Seryl-tRNA synthetase, SARS)の作用により、セリン (Ser)が付加し、O-ホスホセリルtRNA キナーゼ (phosphoseryl-tRNA kinase, PSTK)の作用により、リン酸化セリン (pSer)に変換される。続いて、セレノリン酸合成酵素であるSEPHS1やSEPHS2がセレノリン酸を合成する。さらにセレニウム転移酵素(SEPSECS)がこのセレノリン酸を用いて、pSer-tRNASec上のpSerの水酸基をセレノールに変換することで、Secが合成される。Secのペプチド鎖への取り込みは、mRNA上のリコーディング部位であるUGAコドンの下流にSECISと呼ばれる特徴的なステムループ構造が必要である。また、Sec-tRNASec特異的な翻訳伸長因子EEFSECなどの複数の因子を必要とする。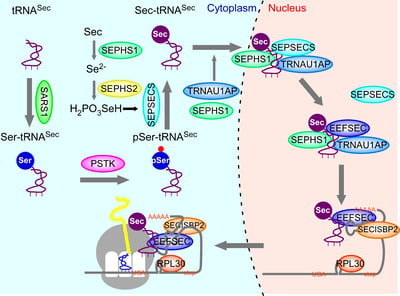 リコーディングによるSecの取り組み
リコーディングによるSecの取り組み
(注5) SELENON関連疾患
SELENON遺伝子に変異があることで生じる先天性の筋疾患(ミオパチー)。生まれながらあるいは幼少期から、筋力低下に関わる様々な症状を呈する。全身の筋緊張の低下に加え、高口蓋、呼吸障害、哺乳・嚥下障害、発育・発達の遅れ、関節拘縮、脊柱異常などを示す。筋疾患は様々な原因遺伝子が知られているが、SELENON遺伝子の変異は重篤な症状を示すことが知られている。
(注6) Alu反復配列
霊長類ゲノムに含まれる約300塩基長のSINE (short interspersed element)として分類されるレトロトランスポゾン(逆転写酵素の作用で増幅する因子)の一種である。その数は100万コピーにもおよび、ヒトゲノムの約11%を占める。主にゲノムの非コード領域に存在するが、遺伝子内の非翻訳領域やイントロンにも大量に存在する。遺伝子内に存在するAlu配列が転写されると、しばしばセンス鎖のAlu配列とアンチセンス鎖のAlu配列が相補鎖を形成し、長い二本鎖RNA構造が生じる。二本鎖RNAはしばしば細胞内ウイルスセンサーであるMDA5に認識され、自然免疫応答を誘導するため、Alu配列はADAR1によるイノシン(I)修飾によって被覆されている。実際に、I修飾の約90%はAlu配列上に生じていることが知られている。また、アンチセンス鎖のAlu配列はUの連続した配列を持っており、この配列がmRNAスプライシングに必要なポリピリミジントラクトとして認識され、しばしばAlu配列の一部がエキソンとして成熟mRNAに取り込まれることが知られている。この現象をAluのエキソン化と呼ぶ。タンパク質のコーディング領域内に生じたAluエキソンのうち、80%以上に、翻訳領域の途中に生じた異常な終止コドン、すなわち未成熟終止コドン(pre-mature termination codon, PTC)を持つため、これらは異常なmRNAとしてNMDの機構によって分解される。一方で、Aluエキソンは有益なエキソンとして獲得される場合もあり、ヒトの多様性や病気に対する抵抗性を獲得するなどゲノムの進化にも貢献していると考えられている。ヒトの選択的スプライシングの生じるエキソンのうち5%以上がAlu配列由来である。
(注7) ナンセンス変異依存mRNA分解機構(nonsense mediated mRNA decay, NMD)
成熟mRNAには、開始コドンから終止コドンの間にタンパク質のアミノ酸配列がコードされているが、しばしばmRNAスプライシングの不具合で読み枠がずれたり、遺伝子のナンセンス変異によって、途中に終止コドンが生じたりすることがある。これを未成熟終止コドン(Pre-mature termination codon, PTC)と呼ぶ。核から細胞質に移行したmRNAが最初に翻訳される際に、未成熟終止コドンを見つけてこのmRNAを速やかに分解する機構がNMDと呼ばれ、mRNAの品質管理機構の1つである。UPF1はNMDに必須の因子の1つである。
(注8)エピトランスクリプトミクス
RNAの構造や機能がRNAの転写後修飾によってダイナミックに制御されることで、遺伝子発現の調節を介して、さまざまな生命現象に関与するという概念。
7.添付資料: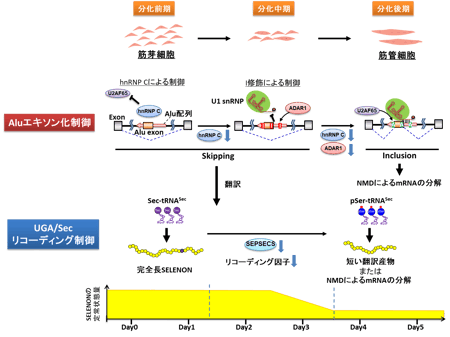 図1. 筋分化過程でSELENONは2つの転写後制御機構により発現量が調節される
図1. 筋分化過程でSELENONは2つの転写後制御機構により発現量が調節される
分化前期から中期にかけては、Aluのエキソン化を抑制することでSELENONの発現量が維持される。分化前期では主に、hnRNP CがAlu配列に結合することでAluのエキソン化が抑制される。中期にかけてhnRNP Cが減少すると、RNAの二次構造が変化し、Alu配列はADAR1に認識されるようになる。ADAR1は、Aluエキソンの5’スプライス部位周辺へI修飾を導入し、U1 snRNAの認識を阻害することで、Aluのエキソン化を抑制する。これらの2つの機構が順番に作用することで、分化前期から中期にかけてSELENONタンパク質の発現量が維持される。中期から後期にかけては、ADAR1も低下し、Aluエキソン化が促進され、正常なmRNAが減少することでSELENONの発現量が低下する。また、Aluエキソン化によって生じた異常なmRNAはNMDにより分解される。さらに後期では、SEPSECSなどのリコーディング因子が低下することで、Secを受容したtRNASecが減少し、活性のあるSELENONは合成されず、またUGA/Secコドンが未成熟終止コドンとして認識されSELENON mRNAがNMDにより分解されることで、完全長のSELENONタンパク質の発現低下が導かれる。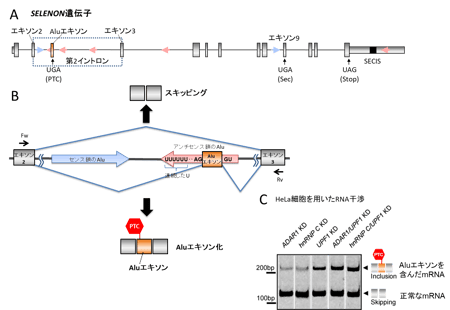 図2. SELENON遺伝子の構成とAluエキソン化のしくみ
図2. SELENON遺伝子の構成とAluエキソン化のしくみ
(A)SELENON遺伝子の全体の構成を示す。エキソン2と3の間の第2イントロンを点線枠で示した。センス鎖およびアンチセンス鎖のAlu配列をそれぞれ青とピンクの矢印で示す。SecをコードするUGAコドン(リコーディング部位)はエキソン9に、SECISエレメントは3’非翻訳領域にある。
(B)エキソン2と3の間を拡大した領域を示す。アンチセンス鎖のAlu配列にはAluエキソンおよびスプライシングに必要なコンセンサス配列を含む。スプライシングによりAluエキソンがスキッピングされると正常なmRNAが生じ、Aluエキソンが取り込まれると、異常なmRNAが生じる。Aluエキソンには未成熟終止コドン (PTC)が生じる。逆転写PCRのプライマーの位置を黒の矢印 (Fw, Rv)で示す。
(C) 逆転写PCR によるAluエキソン化の解析。Aluエキソンを含む異常なmRNA(上のバンド)とAluエキソンがスキッピングされた正常なmRNA(下のバンド)の比率からAluエキソン化を定量した。NMDに必須の因子であるUPF1をRNA干渉によってノックダウンしたところAluエキソンを含む異常なmRNAが増加したことから、NMDの機構で分解されていることがわかる。また、UPF1をノックダウンした状態でADAR1およびhnRNA Cをノックダウンするとさらに異常なmRNAが蓄積したことから、これら2つの因子はAluエキソン化を抑制する役割がある。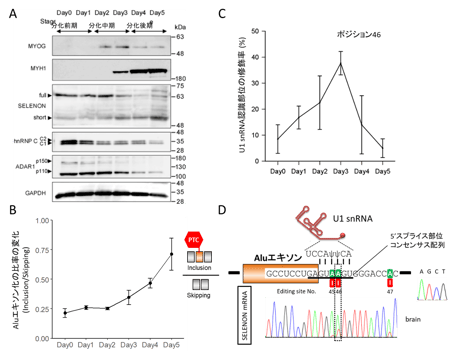 図3. 分化中期にはAluエキソンの5’スプライス部位周辺のI修飾が増加しAluエキソン化を抑制する
図3. 分化中期にはAluエキソンの5’スプライス部位周辺のI修飾が増加しAluエキソン化を抑制する
(A)ウェスタンブロッティングによるHu5/KD3細胞の分化過程におけるタンパク質定常状態量の解析。筋分化のマーカー遺伝子であるMYOG、MYH1の発現より、筋分化誘導からの日数で、Day0とDay1を分化前期、Day2とDay3を分化中期、Day4とDay5を分化後期とした。SELENONの完全長と短い翻訳産物、hnRNP C2とhnRNP C1、ADAR1のp150とp110のアイソフォームを矢頭で示した。GAPDHはコントロールとして用いた。
(B) 筋分化過程におけるSELENONのスキッピングされた正常なmRNA とAluエキソンを含む異常なmRNA量を逆転写 qPCRにより定量した。3回測定した値の平均値と標準偏差を示した。
(C) 筋分化過程におけるSELENON mRNAのAluエキソン5’スプライス部位(U1 snRNA認識部位、position 46)におけるI修飾率。3回測定した値の平均値と標準偏差を示した。
(D) SELENON mRNAのAluエキソン 5’スプライス部位周辺のI修飾とU1 snRNAの認識。波形はサンガーシーケンシングにより得られたクロマト図であり、Iは化学構造がGに類似していることから、I修飾部位では緑のAと赤のGの波形の混在が見られる。このデータはヒト脳由来のRNAを用いた。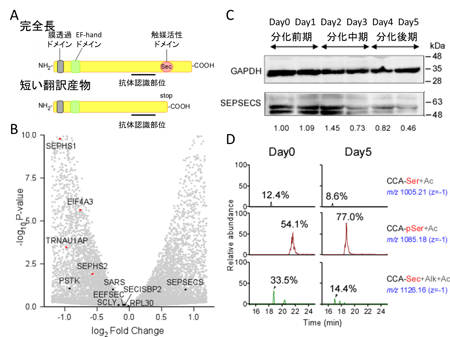 図4. 筋分化の後期にUGA/Secコドンのリコーディングが抑制される
図4. 筋分化の後期にUGA/Secコドンのリコーディングが抑制される
(A) SELENONタンパク質の完全長と短い翻訳産物のドメイン構造の模式図。灰色が膜貫通ドメイン、緑がEF-handドメイン、赤が触媒活性ドメインを表す。また下線は図3Aで用いられた抗SELENON抗体のエピトープ部位を示す。
(B) Hu5/KD3細胞の分化過程におけるRNA-seqでのDay0に対するDay5の発現のvolcano plot。横軸がlog2 fold change、縦軸が-log10 P-valueを示す。赤の点はP-value<0.05 (t検定)で有意に変動しているUGA/Secリコーディング因子を示す。
(C) ウェスタンブロッティングによるHu5/KD3細胞の分化過程におけるSEPSECS発現量の解析。バンドの濃さからSEPSECSの発現量を定量し、コントロールであるGAPDHでノーマライズし、Day0を1とした相対値を下部に示した。
(D) Hu5/KD3細胞分化のDay0 (分化前)とDay5 (分化後)におけるtRNASec末端にアミノ酸が付加したRNase T1消化断片のマスクロマトグラム。配列、m/zおよび価数は右に示した。縦軸はこれら3つの強度の合計を100として表している。
プレスリリース本文:PDFファイル
Nature Communications:https://www.nature.com/articles/s41467-022-30181-2
おすすめ記事
本件に関連する記事はこちら
磁性体の体積はスピン流で変化する ―スピントロニクスを応用した精密機械の力学制御に道―
生物の耐熱性を支える「錠前」の発見 ~可逆的なリン酸化修飾がRNAを安定化する~