発表のポイント
◆ 複数のヒストン修飾酵素が、肝細胞から胆管細胞への分化転換を制御すること、特にH3K36me2の修飾因子であるKdm2aとNsd1が重要な役割を果たすことを発見。
◆ エピジェネティクスと分化転換との間の因果関係を実証。
◆ 肝細胞の胆管細胞への分化転換メカニズムを理解することで、胆管形成不全疾患に対する新たな治療法の開発につながることが期待される。
 肝細胞の胆管細胞への分化転換
肝細胞の胆管細胞への分化転換
概要
東京大学大学院工学系研究科の勝田 毅助教と、ペンシルベニア大学ペレルマン医学大学院のベン スタンガー教授、ジョナサン サスマン大学院生らの研究グループは、マウスを使って肝細胞(注1)が胆管細胞(注2)に変わる「分化転換」(注3)のエピジェネティクス(注4)による制御メカニズムの一部を明らかにしました。
今回の研究では、肝細胞が胆管細胞へと変わる際に、さまざまなヒストン修飾(注5)の分布が変わることを見出しました。特に H3K36me2(注6)の分布の変化が重要であること、またこの変化が Kdm2a と Nsd1 という2つの遺伝子によって引き起こされることも明らかにしました。
さらに、H3K36me2の分布が乱れると分化転換の効率が変化するものの、遺伝子発現自体の変化はごくわずかであり、最終的には正常な場合と同じように分化転換が起こる細胞も存在することがわかりました。この結果は、エピジェネティクスが分化転換を調整する重要な役割を持ちながらも、分化転換の過程自体は安定に保たれている可能性を示しています。
本研究成果は、2025年4月1日付で国際科学誌Genes & Developmentにオンライン掲載されました。
発表内容
2012年に、成体マウスにおいて肝細胞が胆管細胞に分化転換することが報告されました。それ以来、その分子メカニズムの解明が進められ、細胞内外のシグナル伝達経路(注7)の関与が明らかになってきました。また、肝細胞のクロマチン構造(注8)に変化が生じることも確認され、エピジェネティクスの関与が示唆されていましたが、その因果関係や詳細なメカニズムは未解明のままでした。エピジェネティクスには多くの因子が関与するため、特定の仮説を基に研究を進めることが難しかったことが一因と考えられます。
そこで本研究チームは、2段階のスクリーニングを行い、肝細胞の分化転換を制御するエピジェネティクス因子を広範に探索することにしました。まず、ヒストン質量分析(注9)により、分化転換の前後で変動する7つのヒストン修飾を見出しました。次に、これらのヒストン修飾を制御することが知られる30個のヒストン修飾酵素遺伝子を対象に、CRISPR/Cas9(注10)技術を用いたマウス個体内でのノックアウトスクリーニングを実施しました。その結果、8つの遺伝子が分化転換を正または負に制御する可能性があることが明らかになりました。
さらに、これらの遺伝子を個別にノックアウトして詳細な解析を行ったところ、H3K36me2の修飾酵素であるNsd1と、脱修飾酵素であるKdm2aが相互補完的に分化転換を段階的に制御することが判明しました。具体的には、Nsd1は分化転換の初期段階を促進する一方で後期には抑制的に働き、逆にKdm2aは初期に抑制的に働き、後期に促進的に作用するという二段階の制御メカニズムを見出しました(図1)。
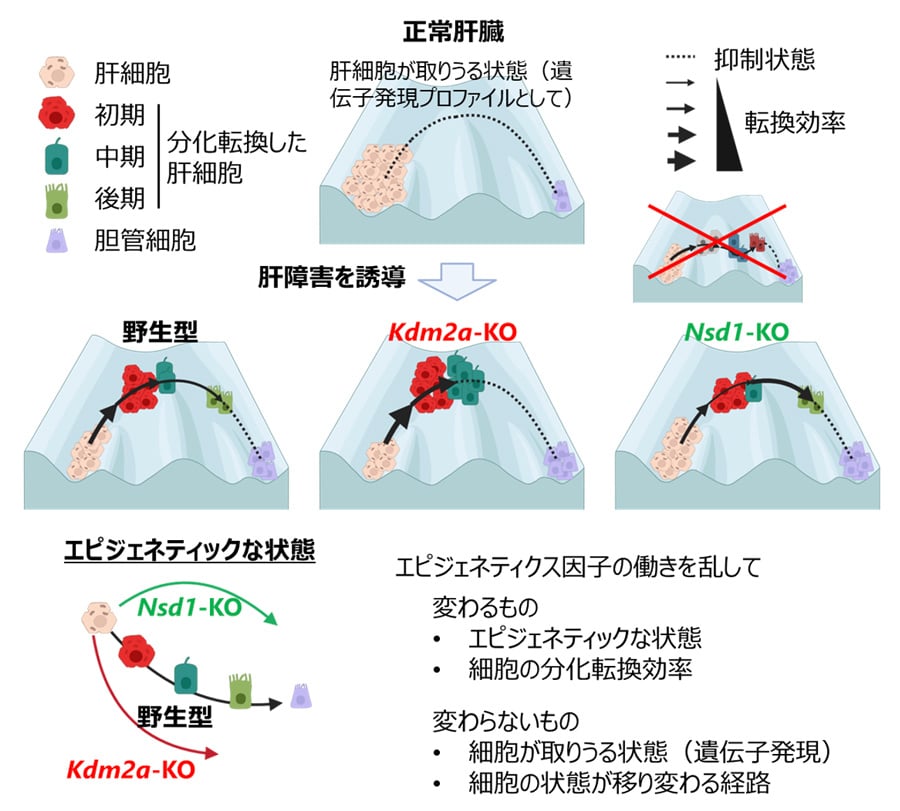
また、これらの遺伝子をノックアウトした細胞を用いて、遺伝子発現とエピゲノム状態をゲノム規模で解析した結果、ノックアウトによりヒストン修飾状態が大きく変化するにもかかわらず、分化転換の各段階での遺伝子発現には大きな変動が見られませんでした(図1)。このことは、分化転換を促進するエピジェネティクス経路が複数存在し、1つの経路が遮断されても他の経路が補完することで同じ遺伝子発現状態を実現できる可能性を示唆しています。こうした冗長性により、肝細胞の分化転換過程が安定に維持されている可能性が示されました。
本研究はエピジェネティクス機構の理解を深めるための基礎的な知見を提供するものと期待されます。今後さらに研究が進めば、肝細胞を胆管細胞へと意図的に分化転換させられるようになる可能性もあります。これが実現すれば、アラジール症候群などの胆管形成不全を伴う疾患に対する新たな治療法の開発につながることが期待されます。
発表者・研究者等情報
東京大学 大学院工学系研究科
勝田 毅 助教
研究当時:ペンシルベニア大学 ペレルマン医学大学院 博士研究員
ペンシルベニア大学 ペレルマン医学大学院
ベン スタンガー(Ben Z. Stanger) 教授
ジョナサン サスマン(Jonathan H. Sussman) 大学院生
論文情報
雑誌名:Genes & Development
題 名:In vivo CRISPR screening reveals epigenetic regulators of hepatobiliary plasticity
著者名:Jonathan H. Sussman#, Hector W. Cure, Salina Yuan, Kenji Ito, Irfan A. Asangani, Benjamin A Garcia, Ben Z. Stanger*, Takeshi Katsuda*,#
(#Co-first author; *Co-corresponding author)
DOI:10.1101/gad.352420.124
URL:https://genesdev.cshlp.org/content/early/2025/03/29/gad.352420.124
研究助成
本研究は、米国立衛生研究所NIHの研究費(課題番号:R01DK083355、 R01DK125387、 HD106051、 CA196539)、Fred and Suzanne Biesecker Pediatric Liver Center助成金、Abramson Family Cancer Research Institute助成金、(公財)上原記念生命財団・海外留学助成金、(公財)ホクト生物科学振興財団・助成金、(公財)持田記念医学薬学振興財団・留学補助金、(公財)かなえ医薬振興財団・海外留学助成金、(公財)日本生化学会・早石修記念海外留学助成金、Abramson Family Cancer Research Instituteポストドクトラルフェローシップの支援により実施されました。
用語解説
(注1)肝細胞:
肝臓の70-80%を占める主要な細胞で、栄養素の代謝、解毒、胆汁の生成など多くの重要な働きを担う。
(注2)胆管細胞:
肝臓内の胆管を構成する細胞で、肝細胞が合成する胆汁を運ぶ管を形成する。肝細胞とは異なる役割を持つ。
(注3)分化転換:
ある種類の細胞が別の種類の細胞に変化すること。本研究で着目する肝細胞から胆管細胞に変わる現象以外にも、膵臓の腺房細胞が膵管細胞に変わる現象など、他の臓器においても観察されている。
(注4)エピジェネティクス:
DNAの配列自体は変えずに、遺伝子の働き方を調節する仕組み。DNAそのものへの化学修飾や、DNAを巻き取っているヒストンとよばれるタンパク質の修飾(注5)などが、調節に寄与することが知られている。
(注5)ヒストン修飾:
DNAが巻きついているヒストンタンパク質に対して起こる化学修飾のこと。代表的なものとしてメチル化やアセチル化があり、これらがヒストンの特定の部位に付加や除去されることでクロマチン構造(注8)や遺伝子発現が調整される。
(注6)H3K36me2:
ヒストンタンパク質の1つ、H3の36番目のリシン(K)にメチル基が2つ付加された状態。この修飾は、遺伝子の発現調節に関わると考えられている。
(注7)シグナル伝達経路:
細胞が外部や内部からの刺激を受け取って反応を引き起こすまでの情報の流れ。たとえば、成長や分化を制御するためのメカニズム。
(注8)クロマチン構造:
DNAとヒストンが複雑に折りたたまれてできた構造。遺伝子発現の調整において重要な役割を果たす。
(注9)ヒストン質量分析:
ヒストンに付加された修飾を定量的に測定する技術。エピジェネティクス研究において、どの修飾がどれくらい存在するかを調べるのに使われる。
(注10)CRISPR/Cas9:
DNAを特定の場所で切断する技術で、遺伝子の編集や操作が簡単に行える。ターゲットとなる遺伝子を改変することで、その機能を調べる研究に使われる。
Genes & Development:https://genesdev.cshlp.org/content/early/2025/03/29/gad.352420.124
プレスリリース本文:PDFファイル
おすすめ記事
本件に関連する記事はこちら


