1.発表者:
酒井 康行(東京大学 大学院工学系研究科化学システム工学専攻 教授)
西川 昌輝(東京大学 大学院工学系研究科化学システム工学専攻 講師)
ファド ガンジー トリザール(東京大学 大学院工学系研究科化学システム工学専攻 特任研究員)
2.発表のポイント:
◆iPS細胞の未分化増幅において、細胞当たりの培養コストを1/8に低減した。
◆細胞保護のための多糖類を添加した透析操作という独自の方法にて、増殖因子の供給量をそのままに従来の8倍程度の超高密度(3.2×107 cells/mLで世界最高)を達成した。
◆iPS細胞の未分化増幅において、細胞当たりの増殖因子の使用量1/8程度に低減できたことは、再生医療のための低コスト培養の実現に重要な技術的指針となる。今後、数十倍のコストのかかる臓器細胞への分化誘導にこの方針が有効であれば、その効果はさらに大きい。
3.発表概要:
東京大学大学院工学系研究科の酒井康行教授らは、(株)カネカと日産化学(株)との共同にて、ヒトiPS細胞の未分化増幅にかかるコストを1/8に低減できる新たな小規模培養システムを開発しました。本研究成果は、2021年11月19日10:00(グリニッジ標準時)に英国の科学誌である「Communication Biology」のオンライン版に掲載されました。
このシステムは透析膜で区切られた上下の2つの空間を持ち、細胞を培養する上部に高価な増殖因子を留めつつ、栄養素や老廃物は下部と自由に交換させるものです。多糖の添加で、従来の8倍の高密度までの増殖が達成されました。透析培養は今まで2例の報告がありますが、低密度しか達成されておらず、コスト削減への効果は全く報告されていませんでした。
今後、数十倍のコストを要する臓器細胞への分化にて同様の効果が見られれば、再生医療における培養コスト削減にとって極めて大きな前進と言えます。今回のシステムは細胞培養部が2 mLと小さなものであり、今後更なるスケールアップは必要です。
なお本研究は、AMED再生医療の産業化に向けた評価基盤技術開発事業の「ヒト多能性幹細胞由来の再生医療製品製造システムの開発(網膜色素上皮・肝細胞)」(代表・紀ノ岡正博))、(株)カネカ、日産化学(株)の支援により実施されました。
4.発表内容:
◆研究の背景・先行研究における問題点
ヒト人工多能性幹細胞(iPS細胞)は再生医療や創薬への応用が高く期待されていますが、大量培養には多くの高価な増殖因子類を必要とすることが実用化への大きな隘路です。この解決のためには、主には低分子化合物による代替が追究されていますが生物学的に限界があり、それらの化合物も実は高価であることからコストダウンには至っていません。一方、培養工学的な工夫として、透析操作による高密度培養が考えられます。これは、透析操作にて添加した増殖因子を細胞近傍に留めると同時に、低分子の栄養素や老廃物を供給・除去するものです。しかし、iPS細胞への適用例は極めて少なく、実証されている効果は培養環境の安定化までであり、高密度化の追究はなされていませんでした。例えばComeらは市販の透析膜付き水平回転型リアクターを用いたヒトES細胞凝集体の浮遊培養において、均一なES細胞凝化と神経系細胞への良好な分化を報告していますが、その到達密度は2×105 cells/mLと通常の低密度培養と同じです (Tissue Eng、 2008)。またNathらは、iPS細胞凝集体の浮遊攪拌培養にて、乳酸除去と増殖因子保持による良好な未分化保持を報告していますが、到達密度は1×106 cells/mLに留まっています(Bioprocess Biosyst Eng, 2017)。またコスト削減への効果は全く報告されていません。
◆研究内容
開発したシステムは、内部に透析膜を持つマルチウェルプレートを用いる旋回培養で、少量の高価な増殖因子入り培地にて多数の条件の検討を可能とする世界的にも極めてユニークな培養系です(図1)。これは透析膜で区切られた上下2つの空間(コンパートメント)からなるもので、上部では高価な増殖因子を添加した培養液で細胞を高密度で培養し、下部には増殖因子を含まない安価な培養液のみを入れます。外部から添加した増殖因子や細胞から自己分泌された増殖因子は高分子であるため透析膜を通ることができず上部に留まりました。一方、栄養素や老廃物は低分子であるため透析膜を容易に通過でき、それぞれ下部からの供給と下部への除去が行われました。さらに、多糖類であるゲランガムを添加することで攪拌による物理的障害を抑制しすることで、抗体医薬の産生に用いられているCHO細胞の高密度培養に匹敵する3.2×107 cells/mL=従来の約8倍という超高密度への到達が可能であることが確かめられました(図1)。
培養液の供給速度と培養液中の増殖因子(FGF2とTGFβ)(注1)の濃度は変えずに、細胞密度を8倍に高めることができたので、細胞当たりの培養コストは単純に1/8に抑制できたこととなります。未分化維持増幅に必要な2つの増殖因子であるFGF2とTGFβのうち、FGF2は細胞によっても自己分泌されるため、培養につれて添加時に比べてその濃度が高くなるという現象が見出されました。一方TGFβは、培養液中で速やかに消失してしまいましたが、TGFβと相補的に働く自己分泌性のNordalの濃度は実は培養につれて増加するという興味深い現象が見られました(図2)。
以上、透析を用いた超高密度透析培養においては、コストの支配要因である外部添加の増殖因子をフルに使用するばかりでなく、細胞の自己組織化能の現れと考えられる自己分泌性の増殖因子をも利用することで、従来の標準的な低密度培養と同一の外部増殖因子の供給にて、多量の細胞を培養可能となったと考えられます。培養液の価格は専ら添加する増殖因子によって決まるので、従来に比べて8倍の高密度化が達成されたため、結果的に細胞当たりの増殖因子の使用量=コストを1/8に抑制できたこととなります。
◆社会的意義・今後の予定
今回は未分化増幅が対象であるが、本当にコストがかかるのは、臓器細胞への分化誘導です。ここでは受精卵からの発生過程を模倣した増殖因子カクテルの逐次添加が行われ、細胞当たりの培養コストは未分化増幅時の数十倍にも上ります。今後は、更なる高密度化を目指すと共に、同様の透析超高密度培養が分化誘導でも有効に働くかを実験的に検討します。すでに肝臓や膵島分化の第一段階(内胚葉分化)においては、超高密度化による1/8程度への増殖因子使用量の低減が可能との結果を得ています(未発表)。一方、今回は細胞培養部で2 mL程度であるので、スケールアップは必須です。しかし、そのシステムでの細胞培養部の体積は通常の1/10程度に小さくすることができる。例えば、3 L/1011 cellsで3 L、1010 cellsで300 mL、109 cellsで30 mLなどと従来の1/8程度となります。実現のためには、超高密度状態での攪拌や酸素供給、透析操作のための細胞と培養液との分離等の課題があり、共同研究先の(株)カネカと鋭意解決に取り組んでいます。
◆謝辞など
本研究は、AMED再生医療の産業化に向けた評価基盤技術開発事業の「ヒト多能性幹細胞由来の再生医療製品製造システムの開発(網膜色素上皮・肝細胞)」(代表・紀ノ岡正博))、(株)カネカ、日産化学(株)の支援により実施されました。
5.発表雑誌:
・雑誌名:「Communication Biology」(オンライン版:11月19日)
・論文タイトル:A miniature dialysis-culture device allows high density human-induced pluripotent stem cells expansion from growth factor accumulation
・著者名:Fuad Gandhi Torizal1,2 *, Qiao You Lau1, Masato Ibuki3, Yoshikazu Kawai3, Masato Horikawa4, Masataka Minami4, Tatsuo Michiue6, Ikki Horiguchi5, Masaki Nishikawa2, Yasuyuki Sakai1, 2
1Department of Bioengineering, School of Engineering, The University of Tokyo, Japan
2Department of Chemical Systems Engineering, School of Engineering, The University of Tokyo, Japan
3Regenerative Medicine and Cell Therapy Laboratories, Kaneka Corporation, Japan
4Materials Research Laboratories, Nissan Chemical Corporation, Japan
5Department of Biotechnology, School of Engineering, Osaka University, Japan
6Department of Life Sciences, Graduate School of Arts and Sciences, The University of Tokyo, Tokyo, Japan
・DOI番号:10.1038/s42003-021-02848-x
6.用語解説:
(注1)FGF2とTGFβ共にヒトiPS細胞の未分化増幅に必須の増殖因子であり培養液コストの大半を占める。前者はFibroblast Growth Factor 2(線維芽細胞増殖因子2)の略、後者はTransforming Growth Factorβ(形質転換増殖因子β)の略である。それぞれ最初に発見された機能に基づいて命名された経緯があり、iPS細胞への影響はそれらの名前に明示的には現れない。
7.添付資料: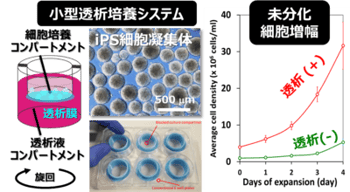 図1.小型簡便透析培養システム(左)と未分化iPS細胞の超高密度増幅(右).細胞コンパートメントは2 mL、透析液コンパートメントは15 mL、透析膜の分画分子量は12,000である。透析操作にて、増殖因子の供給量は増やさずに、約8倍の細胞密度を達成。
図1.小型簡便透析培養システム(左)と未分化iPS細胞の超高密度増幅(右).細胞コンパートメントは2 mL、透析液コンパートメントは15 mL、透析膜の分画分子量は12,000である。透析操作にて、増殖因子の供給量は増やさずに、約8倍の細胞密度を達成。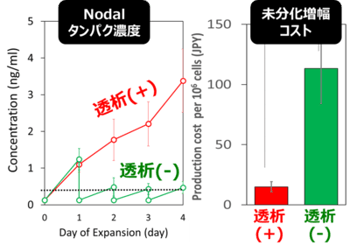 図2.TGFbと相補的に働く自己分泌因子Nodal濃度(左)と、小型透析培養による未分化増幅のコスト削減効果(右).細胞密度を高めても外因性増殖因子の供給速度が同一であるため、細胞密度とコストは単純に反比例する。
図2.TGFbと相補的に働く自己分泌因子Nodal濃度(左)と、小型透析培養による未分化増幅のコスト削減効果(右).細胞密度を高めても外因性増殖因子の供給速度が同一であるため、細胞密度とコストは単純に反比例する。
プレスリリース本文: PDFファイル
Communication Biology:https://www.nature.com/articles/s42003-021-02848-x
おすすめ記事
本件に関連する記事はこちら

